Cáncer de mama: panorama actual de la enfermedad, diagnóstico y tratamiento
Artículo divulgativo sobre cáncer de mama: descubre subtipos moleculares, prevención, detección precoz y tratamientos innovadores, cuidando la salud y fertilidad de las pacientes.
José Hernández
10/17/202549 min leer



Introducción
El cáncer de mama es, fundamentalmente, el crecimiento descontrolado de células que tienen su origen en el tejido mamario. Sin embargo, no basta con esta simple definición, pues el pronóstico y el comportamiento de la enfermedad dependen crucialmente del tipo celular y de características biológicas específicas. Desde un punto de vista práctico, es necesario distinguir el cáncer de mama invasivo, que ocurre cuando las células malignas consiguen atravesar la membrana que confina un conducto o lóbulo, dándoles la capacidad de invadir tejidos adyacentes.
Definición simple: crecimiento anormal de células mamarias
En términos sencillos, el cáncer de mama surge cuando una célula de la mama comienza a acumular alteraciones que le permiten dividirse sin control, eludiendo los mecanismos naturales de "muerte celular programada". Con el tiempo, estas células pueden formar una masa localizada (el tumor primario) y, en algunos casos, pueden diseminarse a ganglios linfáticos o incluso a órganos distantes, lo que denominamos metástasis.
Por cierto, la progresión que supone esta enfermedad varía significativamente por edad, factores de riesgo y región geográfica. De hecho, el diagnóstico temprano, junto con un tratamiento personalizado, ha sido clave para mejorar las probabilidades de supervivencia en las últimas décadas.
Es importante señalar que no todos los tumores mamarios son iguales. Por ejemplo, existen lesiones no invasivas (in situ), que pueden permanecer localizadas, en contraste con otras que demuestran un claro comportamiento infiltrante; esta distinción tiene implicaciones directas en la estrategia terapéutica. Por lo tanto, el objetivo principal del diagnóstico es determinar si hay invasión, el tamaño, la afectación ganglionar y, sobre todo, las características biológicas del tumor, ya que de ello depende la planificación del tratamiento.
Tipos más frecuentes: carcinoma ductal y lobulillar
Los dos grupos histológicos que encontramos con mayor frecuencia son el carcinoma ductal invasivo y el carcinoma lobulillar invasivo, los cuales, juntos, abarcan la mayoría de los diagnósticos. El carcinoma ductal suele originarse en los conductos mamarios y puede mostrar una amplia gama de grados y comportamientos clínicos. El lobulillar, en cambio, se desarrolla en los lobulillos y a veces presenta un patrón de crecimiento más difuso, lo que, por desgracia, puede dificultar su detección mediante técnicas de imagen convencionales.
Además de estos, existen subtipos menos frecuentes, como el mucinoso, el tubular o el metaplásico, cada uno con un comportamiento y pronóstico propios; conocer este subtipo ayuda a que el plan de tratamiento sea mucho más preciso. En ocasiones, estos subtipos más raros necesitan una atención altamente especializada, sencillamente porque su manejo difiere del de los tumores más comunes y porque la evidencia clínica que tenemos es, lógicamente, más limitada.
Clasificación moderna: subtipos moleculares (ER/PR/HER2, triple negativo)
Para entender el cáncer de mama hoy, ya no basta con detectar un bulto. Al contrario, es absolutamente necesario caracterizarlo de forma histológica y molecular. Por ello, la práctica clínica contemporánea combina la histología con la biología molecular. La inmunohistoquímica es una herramienta esencial que evalúa los receptores hormonales (ER/PR) y el receptor HER2, permitiendo clasificar los tumores.
Esta clasificación tiene efectos terapéuticos directos: por ejemplo, los tumores HER2-enriquecidos (HER2+) suelen beneficiarse de terapias anti-HER2, y los luminales (ER/PR+) de terapias hormonales. En el caso del triple negativo (TNBC: negativo para ER, PR y HER2), la quimioterapia y la inmunoterapia toman el papel central. Esta subclasificación también ha demostrado que el TNBC no es una entidad única, pues estudios recientes han identificado subgrupos moleculares dentro de él que pueden orientar tratamientos experimentales o dirigidos.
De hecho, más allá de la IHQ, se han desarrollado perfiles genómicos que refinan la subclasificación e introducen información predictiva sobre cómo podría responder el tumor a diferentes tratamientos. En resumen, hoy se mira al tumor con varias "lentes" –receptorales, genómicas e inmunológicas– y cada una aporta una pieza esencial para la elección del tratamiento.


Tabla: creación propia
Estadios clínicos y su significado práctico
La estadificación clásica (TNM) siempre ha sido la base anatómica del pronóstico, evaluando el tamaño del tumor, la afectación ganglionar y la presencia de metástasis. Sin embargo, hoy se ha avanzado a una estadificación "pronóstica" que va más allá, integrando factores biológicos como los receptores hormonales, el HER2 y el grado histológico.
Esto es vital, pues mejora significativamente la capacidad de predecir el resultado y, por ende, de escoger los tratamientos. Así, dos tumores con el mismo tamaño podrían tener pronósticos muy distintos si difieren en el receptor HER2 o en su índice de proliferación. En la práctica clínica, los estadios tempranos (I y II) son, generalmente, candidatos a terapias locales con intención curativa (cirugía y radioterapia), complementadas con tratamientos sistémicos adyuvantes en función de la biología. En contraste, los estadios avanzados (III y IV) exigen enfoques multimodales, cada vez más basados en terapias sistémicas dirigidas o combinaciones con inmunoterapia, cuyo objetivo es controlar la enfermedad y preservar la calidad de vida.


Tabla: creación propia
¿Por qué ha cambiado el manejo en la última década? (medicina de precisión)
El gran motor de cambio en la última década ha sido la llegada de la medicina de precisión: una estrategia que busca identificar las alteraciones moleculares específicas del tumor para así administrar terapias que ataquen justo esas dianas. Ejemplos concretos de esto incluyen los inhibidores de HER2, los inhibidores de CDK4/6 para los tumores luminales, o los inhibidores de PARP para pacientes con mutaciones BRCA. Incluso en el TNBC, se están incorporando inmunoterapias y agentes dirigidos a subgrupos moleculares, buscando transformar subtipos antes difíciles de tratar en tumores que respondan a dianas precisas.
Por otra parte, el abordaje moderno es integral: considera la anatomía, la biología y el contexto completo del paciente (edad, otras enfermedades o deseos reproductivos). Gracias a esto, la comunicación entre médicos y pacientes es ahora más útil y profunda, ya que permite seleccionar tratamientos que hasta hace poco eran impensables.
Además, herramientas diagnósticas como la biopsia líquida y las técnicas de secuenciación de nueva generación permiten a los especialistas monitorizar los cambios genómicos a lo largo del tiempo, facilitando la adaptación de las terapias ante el desarrollo de resistencias. En suma, la combinación de mejores diagnósticos moleculares y fármacos dirigidos ha transformado no solo la expectativa de vida, sino también la conversación abierta entre médico y paciente sobre las opciones terapéuticas disponibles.
Factores de Riesgo y Prevención: Conocer para Actuar
Afortunadamente, la gran mayoría de los tumores mamarios son catalogados como esporádicos, lo que significa que no son hereditarios. Sin embargo, para poder abordar la probabilidad de desarrollar esta enfermedad de forma efectiva, es crucial que los médicos logren identificar y clasificar los distintos factores que influyen en cada persona. Esto permite una correcta estratificación del riesgo.
Podemos dividir estos elementos en dos grandes grupos: los que no dependen de nosotros y los que sí.
Factores de Riesgo: Lo que no depende de nuestros hechos
En primer lugar, tenemos los factores no modificables, aquellos sobre los que la persona no tiene control directo y que, por lo general, tienen un gran peso en la predisposición. De hecho, la edad avanzada es el factor de riesgo principal, ya que la probabilidad aumenta progresivamente y la mayoría de los diagnósticos se presentan en mujeres que ya han pasado la menopausia.
Otro elemento de peso es la predisposición genética. El ejemplo más claro de esto son las mutaciones en genes como el BRCA1 y el BRCA2, que confieren una susceptibilidad sustancialmente mayor y, por ello, justifican programas de cribado y prevención muy específicos. Por último, la densidad mamaria es un factor igualmente relevante. Esta característica se evalúa mediante la mamografía y se correlaciona con un riesgo superior. Por esta razón, cuando una paciente presenta una densidad mamaria alta —lo que podría dificultar la detección radiológica de un tumor incipiente—, se suele complementar el estudio con técnicas adicionales, como el ultrasonido o la resonancia magnética.
Factores de Riesgo Modificables: El Poder del Estilo de Vida
Sin embargo, no todo está escrito. Existe un segundo grupo, el de los factores de riesgo modificables, que están estrechamente ligados a nuestro estilo de vida y que, afortunadamente, pueden ser alterados. Estos elementos tienen un impacto acumulativo que no debe subestimarse.
Por ejemplo, se ha observado que la obesidad durante la etapa posmenopáusica (vinculada a la producción de estrógenos en el tejido adiposo), la inactividad física o un consumo elevado de alcohol, son hábitos que incrementan la probabilidad de desarrollar la enfermedad. Por otro lado, también se ha constatado que el uso prolongado de terapia hormonal sustitutiva combinada (estrógenos y progestágenos) se asocia con un ligero aumento del riesgo. A modo de contraste, la evidencia sugiere que tanto la lactancia materna como el embarazo a una edad temprana confieren un ligero efecto protector.
Estrategias de Prevención: Primaria y Detección Precoz
Una vez comprendidos estos factores, podemos delinear dos caminos de acción claros en las estrategias de prevención.
La prevención primaria se enfoca directamente en reducir la exposición a los factores de riesgo modificables que mencionamos antes. Sencillamente, esto se traduce en adoptar medidas con evidencia sólida, como mantener un peso corporal saludable, realizar ejercicio físico de forma regular y limitar la ingesta de alcohol.
Por otra parte, la prevención secundaria, conocida también como detección precoz, tiene como fin identificar la enfermedad cuando aún se encuentra en sus fases iniciales, un momento en el que las posibilidades de curación son, por supuesto, mucho mayores. La herramienta principal que utilizamos para esta detección en la población general con riesgo promedio es el cribado con mamografía.
Cribado y Detección Temprana: Las Herramientas Clave
La mamografía mantiene su estatus de estándar de oro para el diagnóstico temprano. Su objetivo principal es inequívoco: reducir la mortalidad al detectar tumores mucho antes de que la persona pueda notarlos o de que se manifiesten los síntomas. Las guías a nivel nacional e internacional suelen recomendar iniciar este cribado a partir de los 40 o 50 años, algo que dependerá de la región y del perfil de riesgo individual.
Por cierto, ¿qué hay de la autoexploración mamaria? Si bien es cierto que, por sí sola, no ha demostrado reducir la mortalidad en ensayos clínicos, sigue siendo muy útil como estrategia de concienciación. Esta práctica es valiosa porque permite que la mujer conozca su propia anatomía y pueda reportar cualquier cambio de forma temprana a su médico. Además de esto, la exploración clínica realizada por un profesional sanitario es una pieza esencial de la evaluación rutinaria, especialmente en el caso de mujeres jóvenes o aquellas que acuden a consulta con algún síntoma.

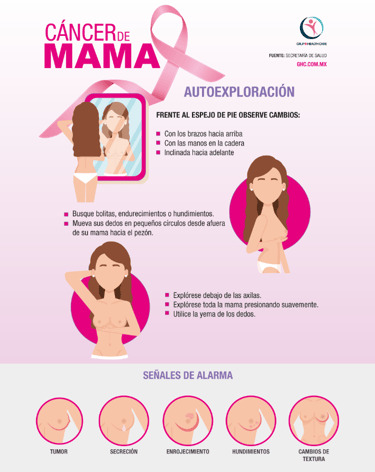
imagen: ghc.com.mx
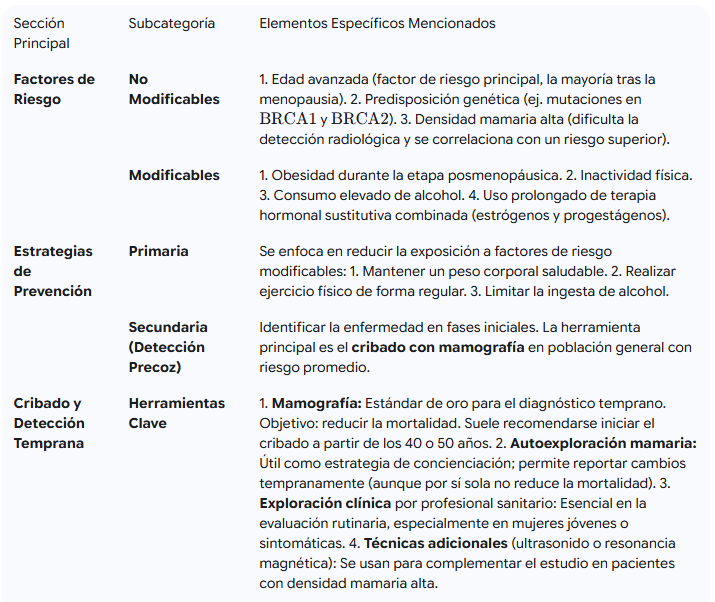

tabla: creacion propia
Síntomas y Señales: ¿Cuándo es el Momento de Preocuparse?
La detección precoz del cáncer de mama es un factor absolutamente decisivo; de hecho, reconocer las primeras señales puede aumentar considerablemente las opciones de tratamiento e, incluso, la probabilidad de curación. Por ello, resulta esencial que el público general se familiarice con aquellos indicios que justifican una evaluación médica sin demora.
El síntoma que casi todo el mundo conoce es la aparición de un bulto o masa en la propia mama o en la axila. Sin embargo, aquí es donde debemos ser cautelosos: no todas las masas son malignas y, por cierto, no todo cáncer se inicia con un nódulo que sea fácil de palpar. La variabilidad en la presentación es enorme. Existen otros signos, a menudo menos obvios, que deben ponernos en alerta. Piense, por ejemplo, en la aparición de hoyuelos o un enrojecimiento persistente en la piel, que puede llegar a tener un aspecto similar a la "piel de naranja". Asimismo, hay que prestar atención a los cambios en la forma o el tamaño del seno, o a cualquier hundimiento o retracción reciente del pezón. Una secreción, especialmente si es sanguinolenta o espontánea, es otro hallazgo que no deberíamos subestimar y requiere un diagnóstico con pruebas de imagen.
Un criterio práctico y muy útil es la persistencia: si se detecta un nuevo engrosamiento o un bulto que no desaparece tras dos o tres ciclos menstruales, se impone la necesidad de consultar a un profesional. ¿Qué pasa con el dolor? En realidad, el dolor mamario aislado es rara vez indicativo de malignidad, pero cualquier molestia nueva y constante que no remita debe valorarse siempre en el contexto de otros posibles cambios. De manera menos frecuente, también podrían aparecer algunos síntomas sistémicos —como la pérdida de peso sin explicación, fatiga o dolor óseo— que, si se presentan junto a los signos locales, exigen una evaluación más exhaustiva ante la posibilidad de una enfermedad avanzada. Por último, si se nota una masa palpable en la axila, aunque la mama parezca totalmente normal, es fundamental investigar, ya que el aumento de ganglios linfáticos puede ser la primera manifestación de un problema mamario.
El Camino hacia el Diagnóstico: El Proceso Escalonado
Cuando existe una sospecha mamaria, la evaluación sigue un principio bien establecido en la clínica: el de la "triple valoración". Este proceso combina la historia médica con el examen clínico, se complementa con pruebas de imagen (mamografía y/o ecografía) y, si es necesario, finaliza con la obtención de una muestra de tejido para su estudio. Este enfoque escalonado es el que garantiza la mayor precisión diagnóstica.
La elección de la técnica de imagen inicial —mamografía o ecografía— se decide en función de varios factores, principalmente la edad y la densidad mamaria de la mujer. Por ejemplo, en pacientes más jóvenes y con tejido mamario denso, la ecografía suele ser la primera prueba complementaria, dado que la mamografía es menos sensible en estas mamas, si bien es la técnica de referencia para el cribado poblacional. La ecografía, por su parte, es especialmente valiosa para distinguir si una lesión palpable es un quiste (líquido) o una masa sólida, además de ser el método ideal para guiar procedimientos como la biopsia.
En casos más complejos, como el alto riesgo genético o cuando hay discrepancias entre la clínica y las imágenes, la resonancia magnética (RM) de mama se convierte en una herramienta insustituible por su altísima sensibilidad, utilizándose también para evaluar la extensión del tumor antes de una cirugía.
Si las imágenes y la exploración sugieren malignidad, el paso definitivo es la biopsia para obtener tejido. Las principales técnicas son la aspiración con aguja fina (FNAC) y la biopsia con aguja gruesa (core needle biopsy). Esta última es la más empleada, pues proporciona material suficiente para la tipificación histológica y la crucial inmunohistoquímica (que analiza los receptores hormonales y el HER2), toda información imprescindible para la planificación del tratamiento. Por cierto, en muchos centros funciona la "clínica de triple valoración", permitiendo que este proceso de examen, imagen y toma de muestra se realice en una sola visita, lo cual reduce la ansiedad y el tiempo de espera del diagnóstico. La precisión diagnóstica mejora claramente cuando las tres modalidades se utilizan conjuntamente, optimizando así la decisión terapéutica.
En conclusión, la secuencia diagnóstica debe ser eficiente y escalonada: de la sospecha clínica a la imagen, y de ahí a la toma de tejido dirigida, para obtener finalmente el informe histopatológico y molecular. Esta coordinación agiliza el proceso y mejora la calidad asistencial. Mientras tanto, la regla práctica para el público general es clara: ante cualquier cambio en la mama que persista, consulte a un profesional. Si vive en una región con programas de cribado, es fundamental que participe, pero si nota alguna alteración fuera de ese calendario, no espere; solicite una valoración clínica. Esta combinación de cribado poblacional con atención individualizada es la que, en última instancia, salva vidas.


tabla: creación propia
Cribado y Detección Precoz
El cribado mamográfico es, sin duda, una de las herramientas de salud pública más estudiadas a nivel mundial. Su principal objetivo es claro: detectar tumores en una fase muy temprana, un momento en el que las posibilidades de curación son mayores y la mortalidad puede reducirse significativamente. No obstante, es crucial entender que este tipo de intervención no está exenta de inconvenientes. De hecho, el cribado puede generar falsos positivos, lo que a su vez conlleva a la realización de intervenciones innecesarias y, por si fuera poco, a un cierto grado de sobrediagnóstico. Por ello, todas las recomendaciones médicas se centran en encontrar el delicado equilibrio para maximizar los beneficios y minimizar los daños potenciales.
En este apartado exploraremos con detalle las distintas pruebas disponibles, como la mamografía, la ecografía y la resonancia magnética (RM). Asimismo, analizaremos el papel crucial que juega la densidad mamaria, los debates abiertos sobre la edad de inicio y la frecuencia de las pruebas, y las últimas novedades tecnológicas, como la Inteligencia Artificial (IA), que están impulsando el cribado basado en el riesgo.
La Mamografía: La Piedra Angular del Diagnóstico Precoz
La mamografía es esencialmente una radiografía especializada de la mama. Su función principal es buscar y detectar nódulos o microcalcificaciones que podrían ser un indicio de cáncer. Por cierto, las nuevas versiones, como la digital o la tomosíntesis (DBT), han mejorado la resolución de la imagen, permitiendo un examen más detallado.
Respecto a quién y cuándo realizarse esta prueba, las guías internacionales muestran algunas variaciones en la edad de inicio y la periodicidad. Sin embargo, la mayoría de las pautas para mujeres con un riesgo promedio sugieren realizar un cribado regular entre los 40 y los 74 años, con una frecuencia que varía localmente entre anual o bienal. En términos de impacto poblacional, los programas organizados que emplean la mamografía han demostrado, consistentemente, ser capaces de reducir la mortalidad por esta enfermedad. Es importante mencionar que la magnitud de este beneficio dependerá siempre de la cobertura que se logre y de la adherencia de la población a las pruebas.
Por otro lado, la tomosíntesis ofrece una ventaja práctica: reduce las tasas de recuerdo (es decir, la necesidad de llamar a la paciente para repetir o complementar la prueba) y puede mejorar la detección de tumores invasivos si la comparamos con la mamografía tradicional en 2D, aunque todavía no está disponible de forma universal.
Ahora bien, para las mujeres que presentan factores de alto riesgo —por ejemplo, un antecedente familiar muy marcado o mutaciones genéticas conocidas—, la mamografía no es suficiente; se integra con otros métodos, y la pauta de inicio suele ser más temprana y la frecuencia, mayor, siguiendo directrices específicas. Finalmente, la decisión sobre la continuidad del cribado en mujeres mayores (por encima de los 75 años, por ejemplo) debe individualizarse, tomando en cuenta su expectativa de vida y otras enfermedades que coexistan; en personas con una baja expectativa de vida, el cribado puede no ofrecer un beneficio neto. En resumen, la mamografía es la herramienta fundamental del cribado, pero requiere ajustes basados en el riesgo individual y las expectativas clínicas de la paciente.
La Complejidad de la Densidad Mamaria y las Alternativas
La densidad mamaria introduce un factor doble en el cribado que complica el diagnóstico: por un lado, se ha demostrado que es un factor que, por sí mismo, aumenta el riesgo de desarrollar cáncer; por otro, el tejido denso tiende a "enmascarar" posibles lesiones, reduciendo la sensibilidad de la mamografía. Por esta razón, muchas jurisdicciones han implementado normativas para informar a las mujeres que tienen mamas densas, ofreciéndoles, si es necesario, opciones de cribado complementarias. Sin embargo, las estrategias varían y la evidencia sobre cómo impactan estos resultados a largo plazo aún se está consolidando.
En este contexto, la ecografía mamaria complementaria emerge como una opción que detecta algunos cánceres que la mamografía pasa por alto en mamas densas. Pero, ¡ojo!, su uso conlleva un incremento en los falsos positivos y, por consiguiente, en la cantidad de biopsias innecesarias. Por ello, su implementación debe sopesarse con base en los recursos disponibles y las preferencias de la paciente.
En un escalón superior en términos de sensibilidad se encuentra la resonancia magnética (RM) de mama. Esta técnica es mucho más sensible y su uso está firmemente recomendado en mujeres con un riesgo muy alto (como las portadoras de ciertas mutaciones). De hecho, estudios recientes, como el llamado estudio DENSE, han demostrado que la RM es capaz de reducir las tasas de cánceres detectados entre mamografías (conocidos como “cánceres intervalo”) en mujeres con una densidad extremadamente alta. Aun así, su adopción generalizada se ve limitada por los costes y la disponibilidad del equipo. Una alternativa que está ganando terreno es la RM abreviada, que logra mantener una alta sensibilidad con tiempos de exploración mucho más cortos, siendo una posible solución intermedia para estas poblaciones. En definitiva, la detección en mamas densas requiere una estrategia personalizada: la mamografía sigue siendo útil, pero complementarla con una ecografía o RM puede mejorar la detección a expensas de un mayor número de falsos positivos.
¿Cuándo Empezar, Cada Cuánto y el Sobrediagnóstico?
El debate sobre cuál es la edad ideal para iniciar el cribado y su frecuencia persiste. Esto se debe a que las decisiones que se tomen deben ponderar constantemente la reducción de la mortalidad frente a problemas como el sobrediagnóstico y, por supuesto, los costes del programa.
Actualmente, encontramos que algunas organizaciones promueven el inicio a los 40 años con revisiones anuales, mientras que otras se inclinan por empezar a los 50 años con periodicidad bienal. Esta discrepancia no es un capricho, sino que refleja distintas interpretaciones de los datos sobre el balance entre beneficio y daño.
El sobrediagnóstico es un problema real y bien cuantificado: se refiere a la detección de cánceres que, de no haber sido encontrados por el cribado, nunca habrían causado síntomas ni la muerte de la paciente a lo largo de su vida. Revisiones poblacionales han estimado tasas variables para este fenómeno, lo cual subraya la necesidad de ser transparentes al comunicar los beneficios y, sobre todo, los riesgos a las mujeres antes de que tomen una decisión.
Otro punto de discusión es la periodicidad: si bien el cribado anual aumenta la sensibilidad, también incrementa los falsos positivos; el cribado bienal tiene el efecto contrario, ya que reduce los falsos positivos, pero podría incrementar la aparición de tumores intervalo en ciertos grupos de mujeres. Por esta razón, las decisiones sobre la edad y la frecuencia están evolucionando hacia enfoques basados en el riesgo individual, abandonando la rigidez de las reglas de “talla única”, un concepto que cada vez es más aceptado por la literatura médica. Finalmente, la experiencia reciente de la pandemia de COVID-19 demostró la vulnerabilidad de estos programas, pues la interrupción del cribado redujo las detecciones, haciendo patente la necesidad de crear sistemas más resistentes y mejor focalizados. En síntesis, no existe una respuesta universal: las pautas deben personalizarse y comunicarse con absoluta claridad, detallando los beneficios, las limitaciones y las alternativas disponibles.
Genética del Cáncer de Mama
El factor hereditario tiene una influencia innegable en una proporción de los diagnósticos de cáncer de mama. De hecho, la genética juega un papel central, pues ciertas variantes hereditarias aumentan de forma sustancial el riesgo de padecer la enfermedad y, por lo tanto, condicionan decisiones cruciales tanto de vigilancia como de prevención. Es importante aclarar que, aunque se hable de riesgo hereditario, la inmensa mayoría de los cánceres de mama son esporádicos. Sin embargo, este concepto se refiere a aquellas alteraciones germinales —que están presentes en todas las células del cuerpo y son, por ende, transmisibles a la descendencia— que elevan la probabilidad de desarrollar cáncer a lo largo de la vida. Identificar a las personas que portan una de estas variantes patogénicas es vital, ya que permite implementar estrategias preventivas que, literalmente, pueden cambiar el pronóstico.
Genes principales implicados
Cuando pensamos en riesgo hereditario, los genes más conocidos y con mayor impacto son BRCA1 y BRCA2. Portar una variante patogénica en cualquiera de estos dos aumenta de forma muy marcada el riesgo de desarrollar no solo cáncer de mama, sino también cáncer de ovario. No obstante, el panorama ha crecido en la última década. Por ejemplo, el gen PALB2 ha emergido como un factor de alto riesgo en algunos estudios, llegando a ser comparable a BRCA en magnitud. Las portadoras de variantes en PALB2 también presentan un incremento sustancial en el riesgo mamario.
Por otro lado, existen genes clasificados como de penetrancia moderada, como CHEK2 y otros como ATM, TP53 o PTEN (estos últimos relacionados con síndromes específicos). Si bien estos también aumentan el riesgo, lo hacen de manera más moderada, y su manejo clínico debe matizarse mucho más en función del historial familiar y de la variante concreta. La diferencia práctica es que los genes de alta penetrancia (BRCA1/2, PALB2 en ciertos casos) confieren un riesgo absoluto muy elevado, mientras que los de penetrancia moderada (CHEK2, ATM) incrementan el riesgo relativo, y su gestión se negocia a menudo teniendo en cuenta la historia familiar. En este contexto, la medicina moderna utiliza paneles multigénicos para analizar simultáneamente decenas de genes relacionados con la predisposición al cáncer, lo que, por fortuna, ha multiplicado la detección de variantes relevantes más allá de los BRCA.
Criterios para Considerar un Test Genético
Las guías médicas han evolucionado rápidamente, y muchas de ellas proponen hoy ampliar los criterios para ofrecer el test genético a más pacientes y a sus familiares. En la práctica, deberían considerar hacerse la prueba, por ejemplo, mujeres diagnosticadas a una edad temprana (como antes de los 50 o 65 años, según los criterios de cada centro), pacientes con tumores triple negativo diagnosticados también a edades precoces, y aquellas con una historia familiar muy significativa de cáncer de mama u ovario.
Sin embargo, el criterio ya no es solo preventivo. También se recomienda ofrecer el test a personas con cáncer recurrente o metastásico que puedan ser candidatas a tratamientos dirigidos. Un ejemplo claro de esto son los inhibidores de PARP, que son altamente eficaces en pacientes que portan mutaciones en BRCA. Por lo tanto, la indicación para el test se basa no solo en la edad al diagnóstico, el subtipo tumoral o la historia familiar, sino, crucialmente, en la posibilidad de que el resultado modifique el manejo clínico o las decisiones de prevención. Por cierto, también pueden beneficiarse de la evaluación genética individuos sanos con una historia familiar muy sólida (como varios familiares de primer grado afectados, cánceres bilaterales o casos de cáncer de mama masculino), siempre tras pasar por el consejo genético pertinente.
Interpretación de Resultados y Pasos Preventivos
Un resultado positivo (la detección de una variante patogénica) es el punto de partida para una batería de medidas. Implica un aumento del riesgo y activa la necesidad de vigilancia intensificada y, en casos seleccionados, opciones para reducir ese riesgo. Para las portadoras de BRCA1/2, las medidas más comunes incluyen una vigilancia clínica y por imagen mucho más temprana y frecuente (a menudo combinando mamografía con resonancia magnética). Adicionalmente, se plantea la posibilidad de cirugía profiláctica, como la mastectomía bilateral reductora de riesgo y la salpingo-ooforectomía (extirpación de ovarios y trompas) para reducir el riesgo de cáncer de ovario.
El gen PALB2, dada su alta penetrancia, puede justificar estrategias similares a BRCA; no obstante, en todos los casos, el consejo especializado y las decisiones individualizadas son esenciales. Para los genes de penetrancia moderada (como CHEK2), la principal recomendación suele ser una vigilancia reforzada, y la opción de la cirugía profiláctica se valora con mayor cautela, ajustando el manejo al gen, la variante específica y, por supuesto, el historial familiar. Hay otra vía preventiva: la quimioprevención (el uso de fármacos como tamoxifeno o raloxifeno), la cual se puede considerar en casos de alto riesgo donde la cirugía no es la opción elegida, sopesando siempre los riesgos y beneficios de forma individual. En cualquier caso, es crucial que la confirmación de los resultados se realice en un laboratorio acreditado y que la clasificación de las variantes se ajuste a guías, evitando así tomar decisiones radicales basadas en variantes de significado incierto (VUS) o mal interpretadas.
Perspectiva Integradora y Recomendaciones Prácticas
En resumen, identificar una variante patogénica en genes como BRCA1/2, PALB2 o CHEK2 va mucho más allá de un simple dato sobre el riesgo. Tiene implicaciones terapéuticas (como el uso de inhibidores de PARP), preventivas (como las cirugías reductoras de riesgo) e incluso reproductivas.
Para los profesionales de la salud, es fundamental ofrecer el test cuando exista una clara indicación, derivar al paciente a consejo genético y discutir a fondo las implicaciones a largo plazo, tanto con el paciente como con su familia. Si usted es paciente, si ha tenido cáncer de mama joven, si su tumor es triple negativo o si tiene una historia familiar importante, la recomendación práctica es: pida información sobre el test genético, ya que un resultado positivo puede abrir nuevas opciones de tratamiento y prevención. Por su parte, los sistemas de salud deben invertir en acceso equitativo a la prueba, en la capacitación de profesionales y en los servicios de asesoramiento genético, una medida que, a la postre, previene cánceres y reduce la mortalidad.
Finalmente, es esencial saber que la genética no es una sentencia: solo identifica un riesgo y permite opciones. Muchas de las medidas preventivas y terapéuticas disponibles hoy dependen, precisamente, de conocer el perfil genético para poder actuar en consecuencia. Es vital la colaboración interdisciplinaria (oncología, genética, psicología reproductiva, cirugía) para asegurar que las decisiones sean informadas, que respeten los valores personales y que estén respaldadas por la evidencia científica. Si está pensando en realizarse una prueba, busque consejo genético antes para entender los posibles resultados; y si ya es portadora, mantenga el seguimiento constante con su equipo, comparta la información con sus familiares en riesgo y pregunte por todas las opciones disponibles, desde la vigilancia hasta la quimioprevención y las cirugías reductoras de riesgo. La aplicación responsable de esta información es, sin duda, una herramienta poderosa en la medicina contemporánea.
La Transformación Tecnológica: IA y el Cribado Personalizado
La Inteligencia Artificial (IA) está revolucionando la forma en que se leen las mamografías. Los algoritmos de detección avanzada ya son capaces de asistir a los radiólogos, ayudándoles a identificar hallazgos sutiles y, lo que es muy importante, reduciendo la carga de trabajo del personal. Ensayos y metaanálisis recientes sugieren que la IA, cuando se utiliza como segunda lectura o para priorizar (triage), puede mejorar la sensibilidad y reducir los falsos negativos. La evidencia, por cierto, continúa acumulándose.
Pero el impacto va más allá de la simple interpretación de la imagen. La creación de modelos híbridos, que combinan datos clínicos, mamográficos y algoritmos de aprendizaje automático, permite predecir el riesgo a corto plazo de cada paciente. Esto, a su vez, facilita la priorización de aquellas mujeres que más se beneficiarían de someterse al cribado. Por ejemplo, la clasificación asistida por IA podría incluso automatizar la derivación a pruebas complementarias como la RM o la ecografía en mujeres con mamas muy densas o con hallazgos sospechosos, optimizando el uso de recursos.
Sin embargo, la aplicación práctica de esta tecnología se enfrenta a diversos retos, entre los que se encuentran la necesidad de validar los algoritmos en poblaciones diversas, lograr la aceptación de los pacientes y radiólogos, establecer regulaciones claras y evaluar su coste-efectividad. A pesar de estos desafíos, los estudios sobre la percepción de las pacientes indican que la mayoría acepta el uso de la IA, siempre y cuando su función se comunique con claridad y el sistema demuestre que mejora los resultados. En este contexto, la transparencia es, por lo tanto, clave. Definitivamente, la combinación del cribado tradicional con la IA y las estrategias basadas en el riesgo individual promete personalizar y eficientizar la detección precoz, aunque su implementación debe llevarse a cabo con prudencia.
Tratamientos que están cambiando el pronóstico del Cáncer de Mama
En la última década, el enfoque terapéutico del cáncer de mama ha experimentado una transformación radical, dejando atrás los tratamientos homogéneos. Hoy día, se combinan diversas herramientas, desde la cirugía y la radioterapia hasta la quimioterapia clásica, sumando las terapias dirigidas, la inmunoterapia y nuevas clases farmacológicas como los antibody-drug conjugates (ADCs). Esta rica variedad de opciones nos permite, de hecho, adaptar la terapia al subtipo biológico específico de cada paciente. A continuación, repasaremos el estado actual de cada una de estas modalidades, analizando cuándo y por qué se utilizan, la evidencia reciente que las respalda y, por último, daremos algunas recomendaciones prácticas sobre cómo manejar sus efectos adversos y cómo valorar la participación en ensayos clínicos.
Cirugía y radioterapia: estado actual y criterios
La cirugía continúa siendo la piedra angular del tratamiento local. Aquí, las pacientes suelen tener dos grandes opciones: la mastectomía o la cirugía conservadora (que implica resección del tumor seguida de radioterapia). La elección se toma en función del tamaño tumoral, la relación entre el tumor y el seno y, por supuesto, las preferencias de la propia paciente. De hecho, gracias a la oncoplástica —una técnica que integra procedimientos reconstructivos en la cirugía conservadora— se han ampliado las posibilidades de preservar la mama incluso en tumores que antes hubieran requerido una mastectomía, lo que mejora los resultados cosméticos sin comprometer la seguridad oncológica.
Por cierto, cuando el tumor es localmente avanzado o se necesita reducir su tamaño para intentar la conservación mamaria, la estrategia preferida es la quimioterapia neoadyuvante; su uso no solo reduce la masa tumoral, sino que también ofrece valiosa información pronóstica, como la respuesta patológica completa (pCR). En cuanto a la radioterapia, la tendencia es clara: se están adoptando regímenes hipofraccionados (menos sesiones con dosis mayores) e incluso ultra-hipofraccionados (como esquemas de solo cinco sesiones). Estos cambios han demostrado ser igual de seguros y eficaces, pero con la enorme ventaja de acortar los tiempos de tratamiento y ser mucho más convenientes para las pacientes. En resumen, tanto la cirugía como la radioterapia evolucionan hacia opciones menos invasivas y más enfocadas en mejorar la calidad de vida, siempre respaldadas por evidencia robusta.
Quimioterapia clásica: cuándo se usa y qué esperar
A pesar de todos los avances, la quimioterapia sistémica sigue siendo un pilar insustituible. Es particularmente crucial en subtipos que muestran una alta agresividad biológica, como el cáncer triple negativo (TNBC), y también se utiliza en la enfermedad metastásica que es sintomática o de rápido crecimiento.
En etapas tempranas del cáncer, la decisión de aplicar quimioterapia se basa en el riesgo estimado, el estadio y la biología tumoral. Por ejemplo, en los subtipos hormonodependientes, existen herramientas genómicas muy sofisticadas que nos ayudan a identificar a aquellas pacientes que pueden evitar la quimioterapia sin comprometer su pronóstico. Sin embargo, en el TNBC de alto riesgo, los esquemas neoadyuvantes intensos siguen siendo el estándar, y la irrupción de la inmunoterapia en combinación ha cambiado completamente el panorama, logrando tasas mayores de respuesta patológica completa (pCR).
Es cierto que los efectos adversos de la quimioterapia (como la alopecia, la fatiga, la neuropatía o la mielosupresión) son bien conocidos. Sin embargo, su manejo ha mejorado notablemente gracias a estrategias preventivas (como el uso de factores de crecimiento y ajustes posológicos) que reducen su impacto y, por consiguiente, mejoran la adherencia al tratamiento. Por último, un dato importante basado en la evidencia reciente: si una paciente no responde adecuadamente a la quimioterapia neoadyuvante, es necesario reevaluar la estrategia adyuvante y considerar alternativas o la participación en un ensayo clínico.
Terapias dirigidas (HER2, PIK3CA, PARP): cómo funcionan y a quién benefician
Las terapias dirigidas son, sin duda, la materialización de la medicina de precisión. Funcionan atacando vulnerabilidades moleculares específicas del tumor. Actualmente, las dianas principales en cáncer de mama son el receptor HER2, la vía PIK3CA y los defectos en la reparación del ADN (especialmente en pacientes con mutaciones BRCA que se benefician de inhibidores PARP).
En el caso del cáncer HER2-positivo, agentes pioneros como trastuzumab o T-DM1 ya habían mejorado enormemente la supervivencia. Sin embargo, más recientemente, fármacos como T-DXd (trastuzumab deruxtecan) han demostrado su eficacia incluso en tumores clasificados como HER2-low, ampliando significativamente la base de pacientes que pueden beneficiarse. De hecho, la evidencia apoya su uso en enfermedad metastásica HER2-low, aunque su toxicidad pulmonar (la neumonitis) exige una vigilancia constante.
Por otro lado, en los tumores hormonodependientes que presentan la mutación PIK3CA, la combinación del inhibidor alpelisib con terapia endocrina ofrece un beneficio clínico importante, pero, sin embargo, requiere la detección previa de esta mutación para personalizar la estrategia. Por último, las mutaciones BRCA1/2 hacen que el tumor sea sensible a los inhibidores de PARP, que han demostrado aumentar la supervivencia tanto en cáncer metastásico como en enfermedad localizada de alto riesgo. En definitiva, es completamente imprescindible identificar estas dianas moleculares mediante pruebas específicas porque la elección del tratamiento y el pronóstico dependen radicalmente de ello.
Inmunoterapia: indicaciones y evidencia reciente
La inmunoterapia, mediante el uso de inhibidores de puntos de control, ha irrumpido con una fuerza notable, especialmente en el cáncer triple negativo (TNBC). De hecho, un ensayo pivotal demostró que incorporar pembrolizumab al tratamiento neoadyuvante aumenta de manera significativa la tasa de respuesta patológica completa (pCR). Esta incorporación está ya cambiando las prácticas quirúrgicas y adyuvantes en pacientes con TNBC de alto riesgo.
Sin embargo, en la enfermedad metastásica, la selección de la paciente es clave y se guía por biomarcadores como el PD-L1, ya que la inmunoterapia funciona mejor en aquellos tumores con un microambiente inflamatorio. Es crucial estar atento a los efectos secundarios inmunomediados (como colitis, neumonitis o endocrinopatías), que requieren protocolos de manejo estrictos que incluyen el uso de corticoides y, a veces, la suspensión temporal o definitiva del fármaco. Por último, la investigación actual se centra en combinar la inmunoterapia con terapias dirigidas o con los ADCs, una estrategia que promete ampliar aún más el número de pacientes beneficiados.
Los antibody-drug conjugates o ADCs son, conceptualmente, moléculas híbridas muy ingeniosas. Podríamos compararlos con un "caballo de Troya" molecular: combinan un anticuerpo que reconoce una diana específica en el tumor con un agente citotóxico muy potente. Esto permite dirigir el fármaco directamente a las células cancerosas, minimizando los efectos sistémicos en el resto del organismo.
Ya contamos con varios ADCs aprobados: T-DM1 para la enfermedad HER2-positiva, y tanto T-DXd como sacituzumab govitecan (que ataca la proteína TROP-2) en el cáncer triple negativo (TNBC). Estos fármacos están logrando respuestas notables incluso en pacientes que ya han recibido tratamientos previos. La evidencia reciente confirma su efectividad en subgrupos que antes eran difíciles de tratar, con respuestas incluso a nivel intracraneal o en tumores HER2-low. Sin embargo, los ADCs plantean desafíos, como la resistencia que se puede adquirir y algunas toxicidades específicas (por ejemplo, la neutropenia o la toxicidad pulmonar en el caso de T-DXd), lo que obliga a un manejo médico especializado. Afortunadamente, el desarrollo de nuevas generaciones promete una mayor selectividad y una reducción de la toxicidad en los próximos años.
Perspectiva y recomendaciones prácticas
El panorama terapéutico del cáncer de mama en 2025 es, sin lugar a dudas, más complejo, pero también profundamente esperanzador. La capacidad de combinar terapias locales con tratamientos sistémicos dirigidos a la biología tumoral está ofreciendo un mejor control de la enfermedad y una mayor supervivencia.
Para los clínicos, la recomendación práctica es clara: deben realizar pruebas moleculares tempranas (HER2, PIK3CA, BRCA) de forma rutinaria, discutir las opciones dirigidas y considerar la inclusión en ensayos clínicos cuando existan dudas terapéuticas. Para las pacientes, informarse activamente sobre la biología de su tumor y preguntar al equipo médico por las opciones de terapias dirigidas o por la posibilidad de ensayos es un camino fundamental para acceder a alternativas con mejor eficacia y calidad de vida. Finalmente, la coordinación multidisciplinar, la atención meticulosa al manejo de los efectos secundarios y el acceso equitativo a estas nuevas terapias son desafíos de salud pública que debemos afrontar para asegurar que los beneficios de la ciencia lleguen, sin excepción, a todas las pacientes.
La Supervivencia después del Cáncer de Mama: Enfocando la Vida a Largo Plazo
El aumento de la supervivencia en el cáncer de mama ha transformado la enfermedad, llevándola de ser un episodio agudo a convertirse en una condición de atención a largo plazo. De hecho, hoy en día, que más mujeres vivan muchos años después del diagnóstico ya no es una mera estadística, sino una prioridad clínica. Por consiguiente, el objetivo de la asistencia sanitaria ha evolucionado: ya no basta solo con lograr la cura; ahora es esencial recuperar la funcionalidad, asegurar el bienestar psicosocial y facilitar la reinserción social.
La experiencia de la supervivencia, por cierto, es profundamente multidimensional. Combina secuelas físicas, como el dolor, la fatiga persistente o el linfedema, con desafíos emocionales, como el duelo, la ansiedad y el abrumador miedo a la recaída. A esto se suman las necesidades prácticas de seguimiento, rehabilitación y el inevitable retorno a la vida social y laboral. Para abordar todas estas áreas de manera efectiva, se necesitan equipos multidisciplinares organizados —compuestos por oncólogos, psicólogos, fisioterapeutas y trabajadores sociales, entre otros— que coordinen la compleja transición desde el tratamiento agudo hasta la atención integral de la superviviente.
Recuperación a través de la Rehabilitación Física
Uno de los pilares de la recuperación es la rehabilitación física. El ejercicio terapéutico se posiciona como una intervención de primera línea. Piense en él como el medicamento más natural para mejorar la capacidad funcional y reducir la fatiga después de la quimioterapia o la cirugía. Los programas que combinan ejercicios aeróbicos y de fuerza han demostrado brindar beneficios sostenidos. No obstante, es fundamental que la prescripción del ejercicio se individualice según la edad de la paciente, las comorbilidades que presente y su estado funcional, estableciendo objetivos realistas para garantizar la seguridad y la adherencia.
Otra complicación crónica que puede aparecer tras la cirugía axilar o la radioterapia es el linfedema del miembro superior. Esta condición afecta no solo a la función física, sino también a la imagen corporal y la participación social. Por ello, su prevención y diagnóstico precoz son cruciales. El tratamiento estándar implica la terapia descongestiva compleja, que incluye vendaje compresivo, drenaje linfático manual y ejercicio específico. Es más, la intervención temprana —cuando la paciente nota un aumento de volumen o una simple sensación de pesadez— ofrece mejores resultados. Por ello, se recomienda una monitorización activa durante el primer año post-tratamiento.
Además, la fisioterapia oncológica se encarga de tratar el dolor neuromusculoesquelético y las limitaciones de movilidad en el hombro o la pared torácica. En este sentido, la educación del paciente es indispensable: aprender sobre las señales de alarma y las medidas de autocuidado asegura que los logros terapéuticos se mantengan a largo plazo. De hecho, integrar la rehabilitación de forma temprana, lo que se denomina prehabilitación, puede optimizar el estado físico incluso antes de empezar el tratamiento, lo que mitiga la gravedad de las secuelas posteriores.

Cuidando la Mente: Salud Mental y Apoyo Psicosocial
Los problemas de salud mental son, lamentablemente, frecuentes entre las supervivientes. La ansiedad, la depresión y, sobre todo, el miedo a la recaída (FCR) son responsables de un deterioro significativo en la calidad de vida. El FCR no es una simple preocupación normal; es una condición que a menudo se manifiesta como una vigilancia hipervigilante de los síntomas, una preocupación persistente y, a veces, una demanda continua de servicios médicos.
Para detectarlo a tiempo, las evaluaciones sistemáticas en las consultas de seguimiento son clave, permitiendo una derivación precoz a psicología o psiquiatría. Las intervenciones psicológicas con mejor evidencia incluyen la terapia cognitivo-conductual (adaptada específicamente al FCR), las técnicas de mindfulness y los programas psicoeducativos grupales.
Hay que tener en cuenta que factores como la incertidumbre del pronóstico o la falta de soporte social aumentan el riesgo psicológico. Además, la fatiga crónica y el dolor crónico contribuyen significativamente a esta comorbilidad psicológica, por lo que un abordaje multimodal —que combine fisioterapia, manejo del dolor y apoyo psicológico— resulta ser la opción más efectiva. Por ello, se recomienda la vigilancia continua de la salud mental durante, al menos, los cinco años posteriores al tratamiento, especialmente en momentos críticos, como al finalizar una terapia o al tomar decisiones reproductivas.


Un Camino Personal: La Reconstrucción Mamaria
La reconstrucción mamaria post-mastectomía es una decisión profundamente personal que impacta directamente en la imagen corporal, la autoestima y la calidad de vida de la mujer. Las opciones principales son la reconstrucción con implantes o la autóloga (mediante colgajos).
La reconstrucción inmediata, realizada al mismo tiempo que la mastectomía, ofrece beneficios estéticos y psicosociales considerables. Sin embargo, exige una cuidadosa evaluación del plan oncológico, ya que la necesidad de radioterapia adyuvante podría aumentar el riesgo de complicaciones. Por su parte, la reconstrucción autóloga (como las técnicas con colgajos DIEP) tiende a ofrecer resultados más naturales y duraderos, aunque supone una cirugía de mayor envergadura y un tiempo de recuperación más largo.
Es crucial que la paciente se informe de manera realista, ya que si bien la mayoría valora positivamente la reconstrucción (según los resultados reportados por las propias pacientes), la incidencia de complicaciones y la posible necesidad de reintervenciones deben discutirse siempre antes de tomar una decisión. Es importante recordar que la reconstrucción no es solo una cuestión estética; para muchas mujeres, es un paso significativo hacia la recuperación psicosocial, si bien no garantiza la ausencia total de secuelas ni la simetría perfecta.
Manteniendo la Vigilancia: Seguimiento a Largo Plazo
El seguimiento post-tratamiento tiene múltiples propósitos: la detección temprana de una recidiva local o de metástasis, la vigilancia de efectos tardíos del tratamiento (como problemas cardíacos o segundos tumores primarios) y, por supuesto, la atención a las necesidades psicosociales y de rehabilitación.
Las guías actuales aconsejan consultas periódicas con el equipo oncológico durante los primeros cinco años, con una prolongación individualizada que puede alcanzar hasta diez años, dependiendo del riesgo tumoral. El pilar de la vigilancia por imagen sigue siendo la mamografía anual o bienal del lado conservado o de la reconstrucción.
El control debe incluir la monitorización de los efectos sistémicos del tratamiento, como la función cardíaca en quienes recibieron ciertas quimioterapias. Por cierto, la aparición de síntomas nuevos y persistentes —como un dolor óseo inexplicable o una pérdida de peso— debe motivar siempre una evaluación dirigida, ya que la recurrencia puede manifestarse de forma sistémica. Las consultas de supervivencia son el momento idóneo para reforzar la prevención secundaria, revisando estilos de vida y promoviendo el ejercicio. En última instancia, una adecuada coordinación de cuidados entre oncología, atención primaria y otras especialidades garantiza que la supervivencia se traduzca, de forma real y sostenida, en una mejor calidad de vida. El establecimiento de expectativas claras sobre qué implica el control y cuándo buscar ayuda por iniciativa propia es, por tanto, fundamental.
El Deseo de Maternidad y el Cáncer de Mama
El diagnóstico de cáncer de mama en edad reproductiva plantea una de las mayores preocupaciones para las pacientes: ¿cómo afectarán los tratamientos a mi fertilidad? Abordar esta inquietud con información clara y precoz se ha convertido en una parte esencial de la atención oncológica de calidad.
De hecho, ha surgido una disciplina especializada, la oncofertilidad, cuyo objetivo primordial es integrar la oncología y la reproducción para conservar la opción reproductiva sin que esto suponga un retraso en el tratamiento oncológico vital. Por lo tanto, el consejo y la planificación pretratamiento deben ser la norma: toda paciente merece conocer los riesgos y las opciones de preservación antes de iniciar quimioterapia, radioterapia o cualquier terapia adyuvante
Impacto del Tratamiento sobre la Fertilidad
La principal causa de la potencial pérdida de fertilidad en mujeres con cáncer de mama es el daño ovárico provocado por la quimioterapia. La magnitud de este efecto varía significativamente según el fármaco empleado, la dosis total y, de forma crucial, la edad de la paciente.
Por ejemplo, agentes altamente gonadotóxicos como los alquilantes o los regímenes intensos que incluyen antraciclinas y/o ciclofosfamida conllevan un riesgo significativo de provocar una insuficiencia ovárica prematura. La edad es el factor determinante más importante, pues la reserva ovárica decrece progresivamente: el mismo régimen terapéutico causará mucho más daño en una mujer de 38 años que en una de 28. Por otra parte, no solo la quimioterapia es un factor; las terapias hormonales prolongadas, recomendadas durante periodos de 5 a 10 años, pueden demorar o complicar la búsqueda de un embarazo debido al tiempo de espera. Por cierto, la radioterapia pélvica u ovárica es claramente nociva, y aunque es infrecuente en el manejo del cáncer de mama, su exposición accidental debe considerarse. Es importante saber que el daño no siempre resulta en infertilidad inmediata: aunque algunas pacientes recuperan la menstruación, su reserva puede estar muy reducida y, consecuentemente, su ventana fértil, acortada.
Técnicas de Preservación: Opciones y Tiempos
Afortunadamente, existen técnicas estandarizadas. Las más utilizadas en la clínica incluyen la criopreservación de óvulos y la criopreservación de embriones, ambas tras un proceso de estimulación ovárica. Estas son la opción estándar siempre que haya tiempo antes de empezar la terapia oncológica. La estimulación ovárica controlada (COS) se lleva a cabo mediante protocolos seguros para el cáncer de mama, a menudo utilizando agentes que bloquean el estrógeno o protocolos "rápidos" (random start) para acortar los plazos.
El tiempo apremia, de hecho, una ronda típica de estimulación requiere entre 10 y 14 días. Por ello, la derivación rápida a un especialista en reproducción asistida es esencial para evitar cualquier retraso en el tratamiento oncológico. Sin embargo, no siempre hay tiempo disponible. En esos casos, o en pacientes pediátricas y adolescentes, la criopreservación de tejido ovárico (fragmentos de corteza) se presenta como una alternativa valiosa, aunque requiera una pequeña cirugía. Es crucial señalar que la preservación de embriones requiere una pareja o un donante de semen, mientras que la preservación de óvulos ofrece mayor flexibilidad futura.
Por otra parte, la supresión ovárica temporal con agonistas de GnRH durante la quimioterapia es una estrategia complementaria y eficaz que reduce la probabilidad de fallo ovárico, especialmente en mujeres premenopáusicas. No obstante, no es totalmente equivalente a la criopreservación de gametos y suele recomendarse como medida adicional. La elección de la técnica, finalmente, depende de la edad, el tiempo disponible y las preferencias personales, lo que subraya la necesidad de un consejo multidisciplinar entre el oncólogo y el especialista en reproducción.
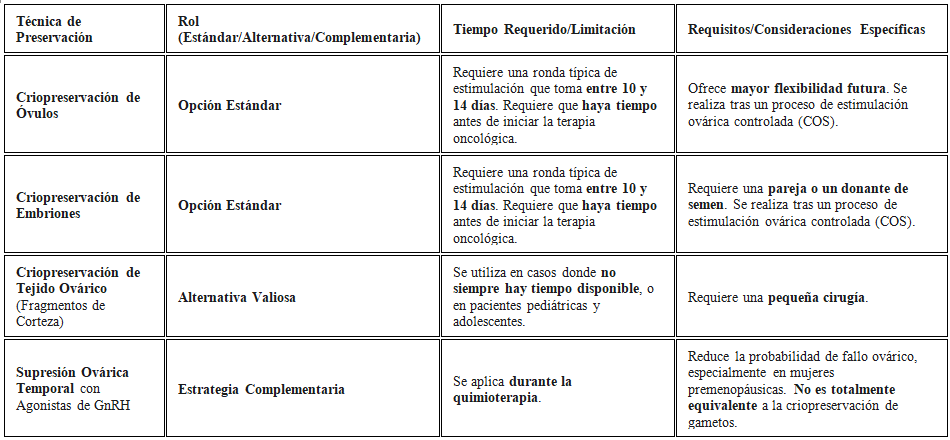
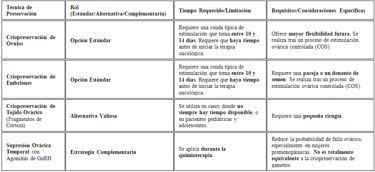
tabla: creación propia
Planificar un Embarazo Tras Cáncer: Riesgos y Recomendaciones
Una de las preguntas más complejas que enfrentan las supervivientes es: "¿Puedo quedarme embarazada de forma segura después del cáncer?". La evidencia acumulada es muy tranquilizadora: en la mayoría de los casos, un embarazo tras cáncer de mama no empeora la supervivencia ni incrementa el riesgo de recidiva.
No obstante, en los tumores hormonoresponsivos, la práctica clínica tradicional aconseja posponer la concepción hasta completar un período de terapia endocrina, lo que a menudo significa esperar hasta cinco años. Esta espera prolongada plantea un dilema significativo para aquellas que tienen una edad reproductiva límite. De hecho, estudios como el POSITIVE están aportando datos vitales sobre la seguridad de interrumpir temporalmente la terapia endocrina en pacientes seleccionadas, ofreciendo un camino alternativo. Las guías internacionales más recientes recomiendan que cualquier decisión de embarazo se tome en centros con experiencia, previa evaluación individualizada del riesgo de recurrencia. Esto es particularmente importante en portadoras de mutaciones de alto riesgo, como BRCA. El uso de técnicas de reproducción asistida tras el cáncer tampoco ha mostrado un aumento claro del riesgo de recaída. En síntesis, el embarazo es posible y, a menudo, seguro; pero requiere una planificación cuidadosa que equilibre el riesgo de recurrencia con la urgencia reproductiva, e incorpore la coordinación constante entre oncología y obstetricia.
Para las mujeres en edad fértil con un diagnóstico de cáncer de mama, solicitar consejo sobre oncofertilidad antes de cualquier tratamiento debe ser un estándar de atención. Siempre que el tiempo lo permita, se debe ofrecer la criopreservación de óvulos/embriones; si no, se deben discutir opciones como la criopreservación de tejido ovárico o la supresión ovárica con agonistas de GnRH.
La planificación del embarazo posterior exige una evaluación multidisciplinar y muy individualizada que considere el subtipo tumoral, el tiempo transcurrido desde el tratamiento y la edad. Es imperativo que las políticas de salud prioricen las rutas rápidas de derivación, la financiación o las ayudas, y la formación de equipos multidisciplinares. En definitiva, la combinación de una información precoz, opciones técnicas disponibles, apoyo emocional y políticas de acceso convierte la esperanza reproductiva en una posibilidad real para muchas mujeres que superan el cáncer de mama.
Preguntas frecuentes y mitos: respuesta clara y práctica


¿La lactancia protege? ¿Los desodorantes causan cáncer?
Dos de las preguntas que más inquietan a la gente son, sin duda, si la lactancia materna confiere protección y si los desodorantes podrían ser un factor de riesgo.
Respecto a la lactancia, la respuesta es afirmativa: los estudios epidemiológicos y las revisiones recientes demuestran consistentemente que amamantar reduce modestamente el riesgo de cáncer de mama. Este efecto protector, por cierto, se potencia cuanto mayor es la duración acumulada de la lactancia, siendo particularmente notable para subtipos específicos, como el carcinoma triple negativo. Es decir, la lactancia no solo aporta beneficios para la madre y el bebé, sino que también ofrece una ventaja preventiva a nivel individual y poblacional. Sin embargo, aunque la reducción del riesgo no es inmensa ni supone una protección absoluta —se trata de una medida preventiva más—, su beneficio está claramente documentado.
En cuanto al uso de desodorantes o antitranspirantes con aluminio, la alarma científica no está justificada. La evidencia acumulada hasta la fecha no ha logrado demostrar una relación causal clara entre su uso habitual y el cáncer de mama en humanos. Aunque se haya encontrado aluminio en tejidos tumorales en algunos estudios, este hallazgo, per se, no prueba que el aluminio sea el agente causante del tumor. Las revisiones concluyen que los datos son insuficientes para establecer una causalidad. Por ello, no existe una recomendación basada en la evidencia que obligue a evitarlos por miedo a desarrollar la enfermedad; si alguien prefiere hacerlo es una elección puramente personal, no una obligación científica.
Alimentación y suplementos: qué recomienda la ciencia


Es un hecho que el estilo de vida y la alimentación influyen en el riesgo de cáncer de mama. Dicho esto, no debemos caer en la trampa de buscar una "dieta milagro" que garantice una protección total. Lo que sí apoya la ciencia son patrones dietéticos y hábitos que logran reducir el riesgo relativo.
Las revisiones contemporáneas avalan los patrones de vida saludables, como una dieta de tipo mediterráneo (rica en frutas, verduras, legumbres, pescado y aceite de oliva). ¿Cómo ayuda esto? Moderan el riesgo mediante el control del peso, la reducción de la inflamación y la mejora del estado metabólico general.
En lo referente a los suplementos, su consumo es alto, especialmente entre mujeres ya diagnosticadas. Sin embargo, la realidad es que la evidencia de un beneficio concreto —como una reducción de la recurrencia o una mejora de la supervivencia— es escasa o nula para la inmensa mayoría de estos productos. Si bien es cierto que algunos suplementos, como el omega-3, pueden ayudar a aliviar ciertos síntomas o efectos secundarios, bajo ningún concepto deben sustituir los tratamientos convencionales ni asumirse como preventivos sin el consejo médico correspondiente. Por cierto, su uso entraña riesgos, pues pueden darse interacciones entre los suplementos y los fármacos oncológicos, o incluso generar efectos adversos por dosis elevadas. Por ello, la recomendación práctica es siempre priorizar un patrón alimentario saludable y consultar con el oncólogo cualquier suplemento que se esté considerando tomar.
Mitos frecuentes
La desinformación alimenta muchos temores infundados. Aquí presentamos una respuesta concisa a los mitos más difundidos, basándonos siempre en el conocimiento científico:
· Mito: "Llevar sujetador causa cáncer de mama". Respuesta: Totalmente falso. No existe evidencia científica que respalde esta afirmación. Se trata de un mito basado en suposiciones, no en datos rigurosos.
· Mito: "La cirugía provoca que el cáncer se disemine". Respuesta: Falso. La cirugía es, de hecho, un pilar fundamental del tratamiento para el cáncer localizado. No hay ninguna prueba de que extirpar el tumor cause metástasis; por el contrario, suele mejorar el pronóstico.
· Mito: "Los productos naturales curan el cáncer". Respuesta: Si bien algunos compuestos pueden aportar beneficios para aliviar los síntomas, no existe ningún suplemento capaz de reemplazar los tratamientos con evidencia contrastada (cirugía, radioterapia, quimioterapia o terapias dirigidas). Siempre debe consultar a su oncólogo.
· Mito: "Si no tengo antecedentes familiares, no puedo tener cáncer hereditario". Respuesta: Aunque el historial familiar eleva la probabilidad, algunas variantes genéticas pueden aparecer por primera vez (de novo), o la historia familiar puede ser sutil. La única forma correcta de descartarlo es mediante una evaluación individualizada.
· Mito: "La mamografía provoca cáncer por radiación". Respuesta: Falso. La cantidad de radiación de una mamografía es ínfima, y el beneficio que aporta en la detección precoz supera ampliamente cualquier riesgo teórico. Las guías médicas están diseñadas precisamente para equilibrar el beneficio y el posible daño.
Referencias:
Abdel-Razeq, H., et al. (2023). Guideline-based multi-gene panel germline genetic testing in breast cancer. PubMed.
Alalwan, M. A., et al. (2023). Awareness of alcohol as a breast cancer risk factor and related patterns. Public Health Journal.
Alkhayat, D. S., et al. (2025). Myths and misconceptions of breast cancer causation.
Alotaibi, B. S., et al. (2024). The accuracy of breast cancer diagnostic tools: mammography, ultrasound and MRI. Diagnostic Imaging Review.
Aloufi, A. S., et al. (2025). Accuracy of abbreviated breast MRI in diagnosing breast cancer. Diagnostic Imaging.
Ambrosone, C. B., et al. (2020). Relationships between breastfeeding and breast cancer subtypes: review of evidence. Breast Cancer Research & Treatment.
Anuszkiewicz, K., et al. (2022). What do we know about treating breast-cancer-related lymphedema?
Arecco, L., et al. (2022). Safety of fertility preservation techniques before and after anticancer treatment in young women with breast cancer.
Aurín, J., et al. (2020). Age at first childbirth and breast cancer risk. Breast Cancer Research.
Batista, M. V., et al. (2024). Trastuzumab deruxtecan in previously treated breast cancer.
Bedrosian, I., et al. (2024). Germline testing in patients with breast cancer: recommendations and implications. PubMed.
Berg, W. A., et al. (2020). Screening algorithms in dense breasts: AJR Expert Panel. American Journal of Roentgenology.
Bharucha, P. P., et al. (2020). Genetic testing and screening recommendations for high-risk individuals. PubMed.
Bischoff, H., et al. (2024). Neoadjuvant therapy: current landscape and future directions.
Bonelli, L. A., et al. (2021). MRI versus mammography plus ultrasound in women (DENSE trial insights). European Radiology.
Boonen, R. A. C. M., et al. (2022). CHEK2 variants: linking functional impact to cancer risk. PubMed.
Boraka, Ö., et al. (2022). Physical activity and long-term risk of breast cancer. European Journal of Epidemiology.
Bottosso, M., et al. (2024). Moving toward precision medicine to predict drug sensitivity in breast cancer.
Boutas, I., et al. (2023). Fertility preservation in young women with breast cancer.
Bu, Y., et al. (2023). Dietary patterns and breast cancer risk, prognosis and survival: a review. Nutrition Reviews.
Carvalho, E., et al. (2025). Molecular subtypes and mechanisms of breast cancer.
Casaubon, J. T. (2023). Fine needle aspiration of breast masses. In StatPearls.
Cassidy, C. M. (2025). Benefits of breast self-examinations for medically underserved populations. Journal of Community Health.
Chen, J., et al. (2025). Online health information seeking behavior among breast cancer patients.
Chen, K., et al. (2023). Recent advances in therapeutic modalities against breast cancer that impact survivorship needs.
Chen, M., et al. (2025). Prevalence and impact of fertility preservation among reproductive-age cancer patients.
Cheng, H. H., et al. (2024). BRCA1, BRCA2 and associated cancer risks.
Chehayeb, R. J., et al. (2025). Breastfeeding attributable fraction of triple negative breast cancer.
Cho, M. J., et al. (2025). The current state of the art in autologous breast reconstruction.
Cho, Y. B. (2025). The effect and treatment of PIK3CA mutations in breast cancer.
Ciurescu, S., et al. (2025). Systematic review and meta-analysis of AI-assisted mammography. Artificial Intelligence in Medicine.
Colomer, R., et al. (2024). Biomarkers in breast cancer: updated consensus.
Condorelli, M., et al. (2021). Safety of assisted reproductive techniques in young cancer survivors.
Connors, C., et al. (2024). Real-world outcomes with the KEYNOTE-522 regimen.
Conroy, M., et al. (2023). Electronic medical record–based electronic messaging and breast cancer care.
Conte, L., et al. (2024). Knowledge and misinformation about breast cancer risk.
Corti, C. (2025). Recent advances in immune checkpoint inhibitors for breast cancer.
Cvetanovic, A. (2024). Pharmacological methods for ovarian function and fertility preservation.
Daly, G. R. (2024). PARP inhibitors in breast cancer: overview.
Davies, C., Williams, A., & Kilbreath, S. (2020). Interventions for breast cancer–related lymphedema: a systematic review.
De, K. (2025). Role of PARP inhibitors: a new hope for breast cancer.
Dehesh, T., et al. (2023). The relation between obesity and breast cancer risk in women: a review. Oncology Reviews.
Denlinger, C. S., et al. (2020). Featured updates to the NCCN Guidelines: survivorship (2020).
De Paola, L., et al. (2025). The era of increasing cancer survivorship: trends in fertility.
de Azua, G. R., et al. (2023). Sustainable return to work among breast cancer survivors: cohort data and insights.
Ditsch, N., et al. (2025). St. Gallen/Vienna 2025 summary: follow-up and survivorship messages.
Dunn, B. K. (2022). Cancer overdiagnosis: A challenge in the era of screening. The Lancet Oncology Review.
Duraes, M., et al. (2022). Fertility preservation in patients of childbearing age treated for cancer.
Eijkelboom, A. H., et al. (2025). Implementation of ultra-hypofractionated radiotherapy for early breast cancer.
Emara, H. M., et al. (2025). Comprehensive review on targeted therapies for triple-negative breast cancer.
EMQN Best Practice Guidelines Committee. (2024). Best practice guidelines for genetic testing in hereditary breast and ovarian cancer (HBOC). PubMed.
Familial Breast Cancer Guideline. (2022). Familial breast cancer: classification, care and managing. In NCBI Bookshelf.
Flemban, A. F., et al. (2023). Overdiagnosis due to screening mammography for breast cancer. Systematic Reviews in Oncology.
Friedewald, S. M., et al. (2025). Triaging mammography with artificial intelligence. Radiology: AI Applications.
Gershfeld-Litvin, A., et al. (2025). Women’s experiences of working while coping with cancer: qualitative perspectives.
Gilchrist, L., et al. (2024). Effectiveness of complete decongestive therapy for upper limb breast-cancer-related lymphedema.
Gozali, A. (2025). Optimizing outcomes in oncoplastic breast-conserving surgery.
Graf, T., et al. (2025). Real-world data from a molecular tumor board.
Grimm, L. J., et al. (2022). Benefits and risks of mammography screening in women. Radiology/Oncology Reviews.
Hadfield, M. J., et al. (2025). Targeted therapeutic approaches for the treatment of breast cancer.
Hamy, A. S., et al. (2025). Time-to-pregnancy in patients with previous breast cancer.
Hanson, H. (2025). CHEK2-related cancer predisposition. In GeneReviews®.
Hauer, M., et al. (2022). Dietary supplement use in women diagnosed with breast cancer.
Hauner, D., et al. (2024). Dietary supplement intake in women with breast cancer. PubMed / NCBI.
Harvey, K. L., et al. (2025). Patient-reported outcomes 3 and 18 months after breast reconstruction: multicenter study.
Hayman, T. J., et al. (2024). Rethinking the use of germline CHEK2 mutation as a clinical decision tool.
Hillers-Ziemer, L. E., et al. (2022). Breast cancer microenvironment and obesity. Cancer & Metabolism Journal.
Ho, P. J., et al. (2025). Impact of personalised risk predictions on breast cancer screening. Cancer Prevention Research.
Hu, L., et al. (2025). Oncofertility barriers in nurses caring for women with cancer.
Huang, N. (2022). The efficacy of clinical breast exams and breast self-exams. Breast Journal.
Hui, L. L., et al. (2025). Potential cost-savings of breastfeeding promotion to reduce breast cancer.
InformedHealth.org. (2024). Breast cancer. In InformedHealth.org.
Jain, A. (2024). Combination strategies with PARP inhibitors.
Jiang, Y., et al. (2025). Association between fear of cancer recurrence and health outcomes in breast cancer survivors.
Karim, M. O., et al. (2020). Triple assessment of breast lump: should we perform core biopsy for every patient? Breast Journal.
Kılıç, B., et al. (2025). The impact of unmet needs on fear of cancer recurrence and psychological outcomes in survivors.
Killow, V., et al. (2022). The past and present of breast cancer resources: quality and readability.
Kim, A. (2025). Breast fine-needle aspiration cytology in the era of core needle biopsy. Diagnostic Cytopathology.
Kleinknecht, J. H., et al. (2020). Pros and cons for breast cancer screening with mammography. Journal of Screening Policy.
Kopans, D. B. (2022). Misinformation and facts about breast cancer screening.
Kotsopoulos, J. (2022). Oral contraceptive use and BRCA-related cancer risk: a balanced view. Genetics in Medicine.
Kozlovsky, N. M., et al. (2025). Pregnancy after breast cancer: latest evidence and recommendations.
Lambertini, M., et al. (2023). Pregnancy after breast cancer in young BRCA carriers.
Lee, J., et al. (2021). Sedentary work and breast cancer risk: A systematic review and meta-analysis. Occupational Health Review.
Li, L. (2025). Adjuvant chemotherapy may be waived for certain breast cancer subgroups.
Lian, C. L., et al. (2021). Triple-negative breast cancer outcomes and AJCC staging.
Liao, D. (2025). Mechanisms and incidence of T-DXd adverse events.
Lu, H., et al. (2020). Information needs of breast cancer patients: Systematic review.
Łukasiewicz, S., et al. (2021). Breast cancer—Epidemiology, risk factors, classification and pathology.
Magnavita, N., et al. (2024). Returning to work after breast cancer: a one-year mixed methods study of personalized interventions.
Maha, R. (2023). Triple assessment breast clinics: The value of clinical core assessment. Breast Clinics Review.
Malherbe, F., et al. (2022). Palpable breast lumps: an age-based approach. Surgical Practice Journal.
Mandriota, S. J. (2023). The postulated innocuity of lifetime exposure to aluminium.
Mango, V. L., et al. (2022). The iBreastExam versus clinical breast examination for detection of breast lesions. Journal of Global Oncology.
Mann, R. M., et al. (2022). Breast cancer screening in women with extremely dense breasts. Breast Imaging Reviews.
Marinas-Sanz, R., et al. (2023). Facilitating factors and barriers in the return to work of cancer survivors: a qualitative synthesis.
Masanam, M. K., et al. (2022). Risk-reducing surgery in PALB2 mutation carriers: outcomes and considerations.
Maxwell, C., et al. (2025). Pregnancy after cancer: FIGO best practice advice. International Journal of Gynecology & Obstetrics.
Meneu, A., et al. (2024). How could physical activity decrease the risk of breast cancer? Public Health Perspectives.
Merose, R. (2025). Prolonged response to PIK3CA inhibition in advanced breast cancer.
Miranda, L. S. (2025). Trastuzumab deruxtecan in previously treated HER2-low disease.
Mota, B. S., et al. (2025). Dense breasts and women's health: which screenings are appropriate? Breast Health.
Moussaron, A. (2023). Correlation between daily life aluminium exposure and health: review. PubMed / NCBI.
Mousavi, M., et al. (2021). The relationship between use of aluminum-containing antiperspirants and breast cancer.
Mustafa, M., et al. (2024). Beyond milk and nurture: breastfeeding's powerful impact on maternal breast cancer risk. Breastfeeding Research.
Myers, S. P., et al. (2024). Impact of neoadjuvant chemoimmunotherapy on surgical management.
Nepute, J. A., et al. (2024). Improved breast cancer detection with artificial intelligence. Breast Radiology Reports.
Nolan, K., et al. (2022). Pregnancy after breast cancer – prognostic safety and outcomes.
Oikonomou, G., et al. (2024). Breastfeeding and its association with breast cancer. Maternal Health Journal.
Papalexis, P., et al. (2024). Precision medicine in breast cancer (Review).
Park-Simon, T. W., et al. (2024). Update 2024: Current standards and future directions in breast cancer therapy.
Patel, P. (2025). Antibody-drug conjugates for early-stage breast cancer.
PDQ® Cancer Genetics Editorial Board. (2024). PALB2: Cancer risks and management (PDQ®). In NCBI Bookshelf.
Perachino, M., et al. (2025). Safety of having a subsequent pregnancy after prior cancer.
Petrucelli, N., Daly, M. B., & Pal, T. (2023). BRCA1- and BRCA2-associated hereditary breast and ovarian cancer (HBOC). In GeneReviews®.
Pimentel-Parra, G. A., et al. (2025). Systematic review of clinical practice guidelines for long-term follow-up after early breast cancer.
Pippin, M. M. (2023). Breast self-examination. In StatPearls.
Plichta, J. K., et al. (2020). Implications for breast cancer restaging based on the 8th AJCC.
Rainville, I., et al. (2020). High risk of breast cancer in women with biallelic CHEK2 variants.
Razeti, M. G. (2021). How I perform fertility preservation in breast cancer patients. Reproductive Medicine Reports.
Ren, W., et al. (2022). Global guidelines for breast cancer screening: A systematic review. Public Health Reviews.
Richman, I., et al. (2022). Breast cancer screening during the COVID-19 pandemic. Journal of Screening Practices.
Roof, K. A., et al. (2024). Maximizing ovarian function and fertility following gonadotoxic therapy.
Ruberu, T. L. M., et al. (2024). Meta-analysis of breast cancer risk for individuals with PALB2 variants.
Ryser, M. D., et al. (2022). Estimation of breast cancer overdiagnosis in a U.S. population. Cancer Epidemiology.
Sabit, H. (2025). Antibody–drug conjugates in breast cancer.
Sawicka, E. (2024). The potential metalloestrogenic effect of aluminum on breast cancer.
Scafuri, L., et al. (2025). Impact of dietary supplements on clinical outcomes and side effects in breast cancer.
Schapira, L., et al. (2025). Cancer treatment and survivorship statistics, 2025.
Sefogah, P. E., et al. (2025). Perspectives on fertility preservation among women living with cancer.
Sella, T., et al. (2021). Impact of fertility concerns on endocrine therapy decisions.
Seth, G., et al. (2025). Awareness of the alcohol–breast cancer link among survivors. Public Health Reports.
Shan, Y., et al. (2023). Susceptibility to breast cancer misinformation among patients.
Shin, S., et al. (2023). Association of food groups and dietary pattern with breast cancer risk: a systematic review and meta-analysis. Nutrition & Cancer.
Silva, E., et al. (2023). Breast biopsy techniques in a global setting—clinical implications. Global Surgery Journal.
Sitges-Serra, C., et al. (2024). Breast MRI to screen women with extremely dense breasts. Breast Cancer Journal.
Sivanushanthan, S., et al. (2023). Patterns of screening mammography and breast MRI during 2018–2020. Clinical Imaging.
Sohi, I., et al. (2024). Alcoholic beverage consumption and female breast cancer: a systematic perspective. Cancer Epidemiology.
Sokolova, A., et al. (2022). Hereditary breast cancer: syndromes, tumour pathology and clinical implications.
Soldato, D., et al. (2023). The future of breast cancer research in the survivorship era.
Soliman, A. M., et al. (2025). Psychological well-being in breast cancer: a literature review.
Sosnowska-Sienkiewicz, P., et al. (2024). Benign and malignant breast lesions in children.
Stroeken, Y., et al. (2024). Quality of life and psychological distress related to fertility in cancer survivors.
Su, Y. (2025). Benign and malignant breast lesions: differentiation using imaging and pathology.
Subhan, M. A., et al. (2023). Recent advances with precision medicine treatment for breast cancer.
Tanas, Y., et al. (2025). Direct-to-implant breast reconstruction in prepectoral placement: outcomes and comparisons.
Thakur, C., et al. (2025). The impact of specific environmental exposures on breast cancer: a contemporary review. Environmental Oncology.
Tendero-Ruiz, L., et al. (2020). The effect of therapeutic exercise in the prevention and treatment of breast cancer-related lymphedema and functional sequelae.
Teplinsky, E., et al. (2022). Online medical misinformation in cancer: distinguishing fact from fiction.
Thomas, A., et al. (2023). Rare subtypes of triple negative breast cancer.
Torres-de la Roche, L. A., et al. (2023). Hormonal contraception and the risk of breast cancer in recent studies. Reproductive Health Journal.
Toss, A., et al. (2023). Management of PALB2-associated breast cancer.
Tsapatsaris, A., et al. (2021). Barriers to breast cancer screening are worsened amidst sociodemographic inequalities. Public Health Reports.
Tsyganov, M. M., et al. (2023). Mutations of BRCA1, BRCA2 and PALB2 genes in breast cancer cohorts.
Tudela, A. C. (2024). Ultra-hypofractionated radiotherapy outcomes.
Turner, K. M., et al. (2021). Heterogeneity within molecular subtypes of breast cancer.
Tzenios, N., et al. (2024). The impact of BMI on breast cancer: an updated systematic review and meta-analysis. Breast Cancer Epidemiology.
Uematsu, T., et al. (2022). Sensitivity and specificity of screening mammography by density and age. Radiology Studies.
Valle, I. (2025). Antibody–drug conjugates in breast cancer: recent advances.
Vangsness, K. L., et al. (2025). Barriers to post-mastectomy breast reconstruction.
Versaggi, S. L. (2024). Stereotactic and needle breast biopsy. In StatPearls.
Wang, Y., et al. (2022). Comparison of ultrasound and mammography for early detection of breast cancer: a systematic review and meta-analysis. Ultrasound in Medicine & Biology.
Wang, Z., et al. (2025). A qualitative study of fertility preservation experience in young cancer patients.
Weidlinger, S., et al. (2025). High impact of chemotherapy on ovarian reserve in breast cancer.
Wei, M., et al. (2020). A benign and malignant breast tumor classification.
Woolf, R. R., & Jones, R. R. (2024). Invited perspective: new motivations and future directions on environmental exposures and early-onset breast cancer. Environmental Health Perspectives.
Zhou, M. (2025). The next frontier in ADC development: challenges and opportunities.
Zhu, H., et al. (2021). American Joint Committee on Cancer's staging system for breast cancer (8th ed.).