Cardiopatía Congénita: Una Revisión Simplificada
José Hernández Jiménez
2/13/202514 min leer

Cardiopatía Congénita: Una Revisión Simplificada
Introducción
La cardiopatía congénita (CHD, por sus siglas en inglés) es el defecto congénito más común, afectando aproximadamente al 1% de los recién nacidos en todo el mundo. Se trata de un conjunto de alteraciones estructurales del corazón y los grandes vasos sanguíneos que se originan durante el desarrollo fetal. Estas anomalías pueden comprometer el flujo sanguíneo, generando repercusiones clínicas que varían desde cuadros asintomáticos hasta insuficiencia cardíaca grave.
La cardiopatía congénita representa una de las principales causas de mortalidad infantil, aunque los avances en diagnóstico y tratamiento han permitido mejorar la esperanza y calidad de vida de muchos pacientes. Su origen es multifactorial, con una combinación de factores genéticos y ambientales que influyen en su desarrollo. En este contexto, resulta fundamental comprender la fisiología del corazón, sus adaptaciones durante la vida fetal y las alteraciones que conducen a la enfermedad.
A continuación, exploraremos los principales tipos de cardiopatías congénitas, su impacto en la circulación sanguínea y los factores de riesgo implicados en su aparición
El corazón es el órgano central del sistema circulatorio y está compuesto por cuatro cavidades: dos aurículas (derecha e izquierda) y dos ventrículos (derecho e izquierdo). Su función es impulsar la sangre oxigenada a los tejidos y devolver la sangre desoxigenada a los pulmones para su reoxigenación. Este proceso es regulado por cuatro válvulas:
Válvula mitral (bicúspide): Separa la aurícula izquierda del ventrículo izquierdo.
Válvula tricúspide: Separa la aurícula derecha del ventrículo derecho.
Válvula aórtica: Regula la salida de sangre del ventrículo izquierdo hacia la arteria aorta.
Válvula pulmonar: Controla el flujo de sangre desde el ventrículo derecho hacia la arteria pulmonar.
El corazón, además, está compuesto por tres capas: el pericardio (capa externa protectora), el miocardio (tejido muscular encargado de la contracción) y el endocardio (capa interna que recubre las cavidades y válvulas). Su función se encuentra regulada por un sistema eléctrico interno, donde el nódulo sinusal actúa como marcapasos natural, generando impulsos eléctricos que controlan los latidos cardíacos.
El Corazón y la Circulación: Bases para Comprender la Cardiopatía Congénita
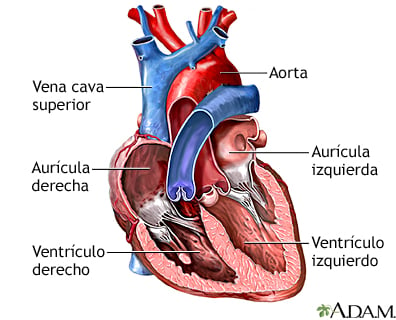
Figura: mEDLINEPLUS.GOV
Durante la vida fetal, la circulación sanguínea es diferente a la del adulto, ya que el oxígeno y los nutrientes provienen de la placenta a través del cordón umbilical. Para garantizar un flujo sanguíneo eficiente, existen tres comunicaciones vasculares clave:
Conducto venoso: Dirige la sangre oxigenada desde la placenta al corazón fetal.
Foramen oval: Permite que la sangre pase directamente de la aurícula derecha a la aurícula izquierda, evitando la circulación pulmonar.
Conducto arterioso: Une la arteria pulmonar con la aorta, facilitando la perfusión sistémica sin necesidad de que la sangre pase por los pulmones.
Al momento del nacimiento, estos cortocircuitos fetales se cierran progresivamente, adaptando la circulación a la vida extrauterina. Sin embargo, en algunas cardiopatías congénitas, este proceso no ocurre de manera adecuada, lo que puede generar alteraciones hemodinámicas significativas.
Circulación Fetal y Adaptaciones Postnatales
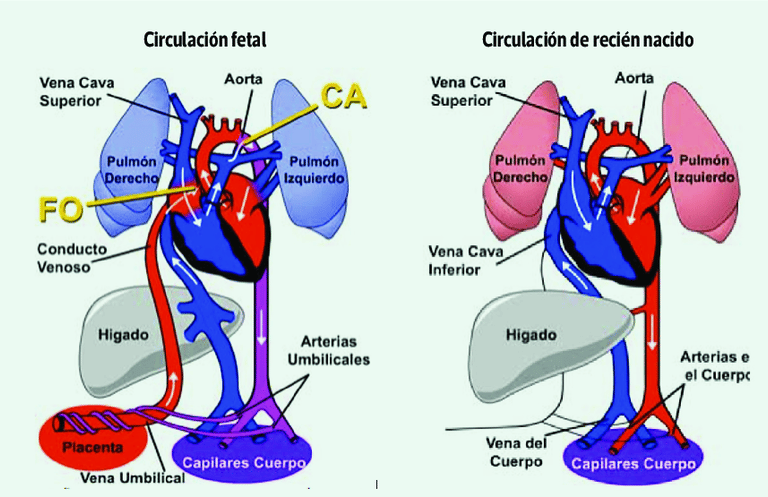
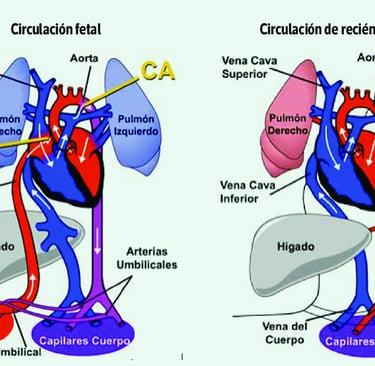
Figura: EL PULMÓN AL MOMENTO DE NACER. (2023). Neumología Pediátrica, 18(2), 32-36.
Las cardiopatías congénitas pueden clasificarse en dos grandes grupos según la presencia o ausencia de cianosis, una coloración azulada en la piel causada por niveles bajos de oxígeno en la sangre.
1. Cardiopatías Cianóticas
Ocurren cuando la sangre desoxigenada se mezcla con la sangre oxigenada debido a un cortocircuito de derecha a izquierda, lo que reduce la cantidad de oxígeno disponible en la circulación sistémica. Las principales cardiopatías cianóticas incluyen:
Tetralogía de Fallot (TOF)
Transposición de los grandes vasos (TGA)
Atresia tricuspídea
Tronco arterial común
Drenaje venoso pulmonar anómalo total
2. Cardiopatías No Cianóticas
En estas patologías, la oxigenación de la sangre no se ve comprometida de forma significativa, aunque pueden existir alteraciones en el flujo sanguíneo. Algunos ejemplos son:
Comunicación interventricular (CIV)
Comunicación interauricular (CIA)
Conducto arterioso persistente (CAP)
Coartación de la aorta
Estenosis aórtica y pulmonar
Aproximadamente el 25% de los casos de CHD requieren intervención quirúrgica durante el primer año de vida, lo que representa un desafío en términos de diagnóstico y tratamiento.
Clasificación de la Cardiopatía Congénita
La etiología de la cardiopatía congénita es compleja y multifactorial. Entre los principales factores de riesgo se incluyen:
1. Factores Genéticos
La prevención a través de un adecuado control prenatal y la suplementación con ácido fólico han demostrado ser estrategias eficaces para reducir el riesgo de algunas cardiopatías congénitas.
Las cardiopatías congénitas representan una de las principales causas de enfermedad cardiovascular en la infancia. Su origen puede estar determinado por factores genéticos, ambientales o una combinación de ambos, lo que resalta la importancia de su diagnóstico y tratamiento precoz.
Algunas cardiopatías están asociadas con alteraciones cromosómicas y mutaciones genéticas. Se han identificado varias condiciones que predisponen a estos defectos, como:
Síndrome de Down
Síndrome de DiGeorge
Síndrome de Marfan
Síndrome de Noonan
Síndrome de Turner
2. Factores Ambientales Maternos
El entorno intrauterino desempeña un papel clave en el desarrollo cardíaco. Algunos factores maternos que pueden influir en la aparición de CHD incluyen:
Deficiencia de ácido fólico
Consumo de alcohol, tabaco o drogas durante el embarazo
Infecciones maternas (como rubéola o citomegalovirus)
Diabetes materna mal controlada
Gracias a los avances en la cardiología pediátrica, la mayoría de los niños con CHD pueden recibir intervenciones quirúrgicas y médicas que mejoran su pronóstico. Sin embargo, siguen existiendo desafíos en la detección temprana y en la accesibilidad a tratamientos especializados, especialmente en países con recursos limitados.
El estudio continuo de la biología del desarrollo cardíaco y la genética permitirá en el futuro un mejor entendimiento de estas patologías y el diseño de estrategias más eficaces para su prevención y manejo clínico.
Factores de Riesgo y Causas de la Cardiopatía Congénita
Figura: Woods et al. Factor von Willebrand y Enfermedad de von Willebrand: nuevos enfoques diagnósticos; Federación Bioquímica de la Provincia Buenos Aires; Acta Bioquímica Clínica Latinoamericana; 50; 2; 6-2016; 273-290
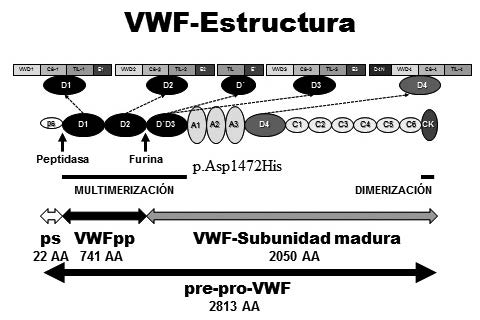
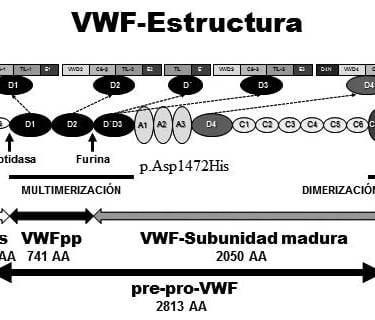
El diagnóstico temprano es crucial en las cardiopatías congénitas, por lo que muchas investigaciones se centran en identificar biomarcadores y parámetros bioquímicos que permitan predecir complicaciones postoperatorias. Algunos de estos biomarcadores incluyen el lactato sérico, NT-ProBNP, PaO₂, creatinina sérica, albúmina sérica y glucosa. Su análisis puede proporcionar información valiosa sobre la evolución de los pacientes, ayudando a prevenir complicaciones y mejorar los resultados clínicos.
Por ejemplo, niveles elevados de lactato sérico indican una deficiencia en el suministro de oxígeno a los tejidos, lo que puede retrasar la recuperación tras una cirugía. De manera similar, la NT-ProBNP, una hormona liberada por el corazón en respuesta al estrés, se asocia con una mayor mortalidad y necesidad de soporte inotrópico. En contraste, niveles bajos de albúmina sérica pueden ser un indicador de desnutrición, lo que prolonga la hospitalización y afecta la recuperación cardíaca.
Otro factor importante en el pronóstico es la activación preoperatoria del factor de von Willebrand (VWF), que se relaciona con un mayor riesgo de trombosis postoperatoria. Estos hallazgos refuerzan la necesidad de estudios prospectivos y retrospectivos para determinar qué biomarcadores tienen mayor valor predictivo en pacientes con cardiopatías congénitas.
Importancia de los Biomarcadores y Pruebas Genéticas en el Diagnóstico y Pronóstico de las Cardiopatías Congénitas
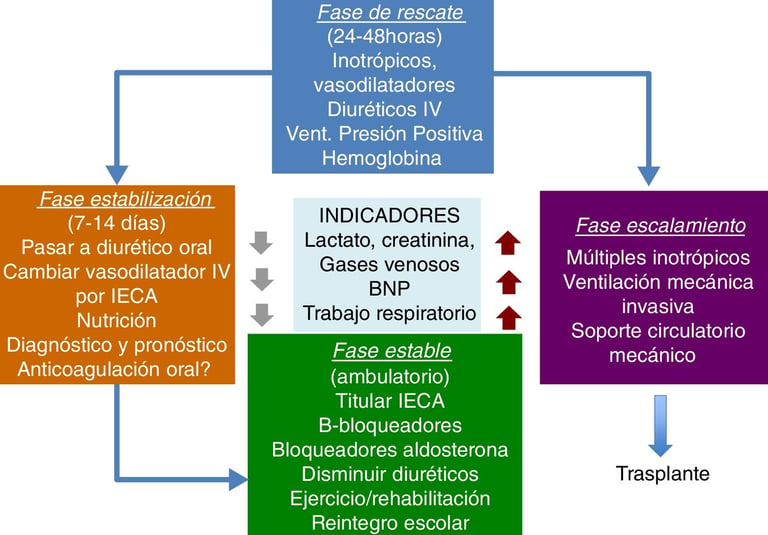
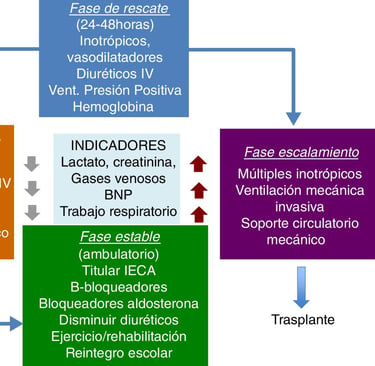
Figura: Cassalett-Bustillo. Falla cardíaca en pacientes pediátricos. Fisiopatología y tratamiento. Parte II. 2018. Revista Colombiana de Cardiología
Dado que las cardiopatías congénitas afectan aproximadamente 1 de cada 110 nacidos vivos, los avances en el diagnóstico prenatal han sido fundamentales para mejorar los resultados clínicos. La ecocardiografía fetal permite una evaluación detallada de la anatomía y función cardíaca antes del nacimiento, facilitando la planificación de estrategias de manejo perinatal personalizadas.
Un enfoque multidisciplinario, que incluya cardiólogos fetales, neonatólogos y especialistas en medicina materno-fetal, es esencial para garantizar un tratamiento oportuno y coordinado. Patel et al. han demostrado que las características ecocardiográficas fetales pueden predecir la gravedad de la inestabilidad hemodinámica neonatal, permitiendo intervenciones más precisas.
Entre las técnicas diagnósticas más innovadoras se encuentra la prueba de hiperoxia materna aguda (HMA), que evalúa la respuesta del feto al oxígeno inhalado. Esta prueba, realizada generalmente después de las 34 semanas de gestación, puede ayudar a predecir la fisiología postnatal en cardiopatías congénitas complejas.
Importancia de las Pruebas Genéticas en Cardiopatías Congénitas
Las pruebas genéticas han demostrado ser herramientas clave para identificar la causa subyacente de muchas cardiopatías congénitas. Estas pruebas no solo permiten un diagnóstico más preciso, sino que también ayudan a detectar comorbilidades asociadas, facilitar la planificación reproductiva y optimizar los tratamientos. Sin embargo, su uso sigue siendo limitado: solo el 55% de los recién nacidos con cardiopatía congénita quirúrgica se someten a estas pruebas, a pesar de que tienen un rendimiento diagnóstico del 44%.
Entre las pruebas genéticas más utilizadas se encuentran:
1. Análisis de cromosomas:
Permite identificar anomalías cromosómicas como trisomías (ej. trisomía 21 en el síndrome de Down, trisomía 18) y deleciones. El síndrome de deleción 22q11.2, identificado en 1981, es una de las variantes más comunes en pacientes con cardiopatía congénita.
2. Microarray cromosómico (CMA):
Detecta variantes del número de copias (CNV) con mayor precisión que el cariotipo, permitiendo diagnosticar afecciones como la deleción 1p36 y la deleción 6q25.1, ambas asociadas a cardiopatías congénitas y miocardiopatías.
3. Secuenciación del exoma:
Analiza los genes codificantes del ADN, cubriendo aproximadamente 1-2% del genoma, y ha identificado variantes en genes como MYBPC3 (locus 11p11.2), asociado con miocardiopatías. Su uso ha permitido un diagnóstico en hasta el 33% de los casos de cardiopatía congénita familiar.
4. Secuenciación del genoma completo:
Examina todo el ADN nuclear, incluyendo regiones no codificantes involucradas en la regulación de la transcripción genética. Esta técnica es superior a la secuenciación del exoma y ha identificado variantes patogénicas en el 27-46% de los pacientes con cardiopatía congénita y miocardiopatías.
5. Secuenciación del genoma mitocondrial:
Detecta alteraciones en el ADN mitocondrial, esenciales para comprender las cardiopatías relacionadas con el metabolismo energético del corazón. Sin embargo, la variabilidad de la carga mutacional en diferentes tejidos hace que su análisis sea más complejo.
Desafíos y Perspectivas Futuras
A pesar de los avances en pruebas genéticas, las variantes de significado incierto siguen representando un desafío clínico. Algunas mutaciones raras en genes como SNIP1 (locus 1p34.1) y SHROOM3 (locus 10q22.1) han sido asociadas recientemente con enfermedades cardíacas, pero su relevancia aún está en estudio.
El uso de inteligencia artificial y procesamiento de lenguaje natural ha mejorado la interpretación de datos genéticos, pero aún es necesario desarrollar enfoques estandarizados para mejorar la precisión diagnóstica.
En el futuro, se requerirá más investigación clínica y traslacional para entender mejor los mecanismos genéticos de las cardiopatías congénitas y optimizar las estrategias de diagnóstico y tratamiento.
El diagnóstico temprano y preciso de las cardiopatías congénitas es fundamental para mejorar los resultados clínicos. Los biomarcadores como lactato sérico, NT-ProBNP y albúmina sérica son herramientas útiles para predecir complicaciones postoperatorias, mientras que las pruebas genéticas permiten identificar causas subyacentes y diseñar estrategias terapéuticas personalizadas.
Aunque la genética ha revolucionado el diagnóstico de estas enfermedades, su aplicación clínica sigue siendo limitada. La implementación de enfoques multidisciplinarios e integrados es esencial para optimizar el manejo de los pacientes con cardiopatía congénita y mejorar su pronóstico a largo plazo.
Avancers en el Diagnóstico Prenatal
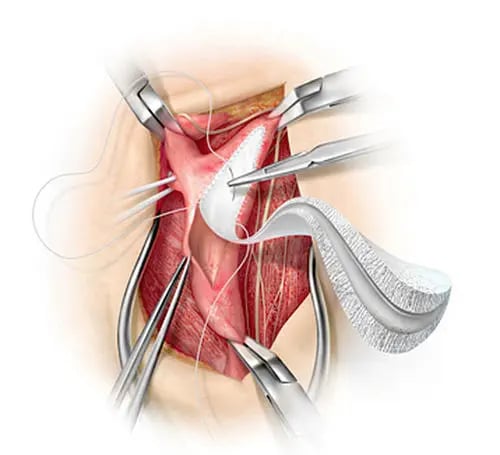
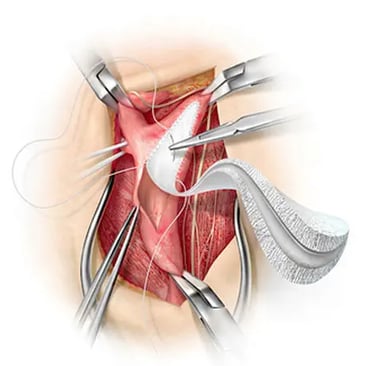
Figura: medicalexpo.es
Tratamientos
Los procedimientos quirúrgicos han sido fundamentales en el manejo de pacientes con cardiopatías congénitas graves, especialmente en aquellos diagnosticados con atresia tricuspídea, atresia pulmonar, coartación de la aorta y tetralogía de Fallot (TOF). Estos tratamientos incluyen el uso de injertos protésicos, válvulas mecánicas y otros dispositivos fabricados con materiales como Dacron, GORE-TEX® (poli(tetrafluoroetileno - PTFE)), entre otros. Sin embargo, estos materiales presentan varias desventajas, como una durabilidad limitada, dificultades para el crecimiento y la remodelación, riesgo de trombosis, efectos hemorrágicos debido a la anticoagulación, calcificación, endocarditis y otros problemas.
A pesar de estas limitaciones, se han desarrollado injertos protésicos de corta duración que requieren múltiples intervenciones quirúrgicas a lo largo de la vida del paciente. Entre los materiales más comunes se encuentran Dacron, válvulas mecánicas y conductos GORE-TEX®, además de injertos xenogénicos y homólogos descelularizados (generalmente de origen porcino y bovino). Aunque estos materiales son duraderos, su uso puede generar respuestas inmunológicas adversas, degradación del colágeno y dependencia a largo plazo de la anticoagulación, con el consiguiente riesgo de sangrado. Además, se enfrentan a problemas como la falta de disponibilidad, la susceptibilidad a la calcificación y una capacidad limitada de crecimiento o remodelación in vivo.
Aunque los autoinjertos presentan ventajas como menor riesgo de respuesta inmunológica y un mejor perfil hemodinámico, su disponibilidad es limitada y están expuestos a la dilatación, lo que puede causar regurgitación valvular. Por otro lado, Dacron y GORE-TEX® son materiales fácilmente disponibles, pero presentan desafíos significativos, especialmente cuando se usan en procedimientos como el Fontan extracardíaco para tratar pacientes con TOF. En estos casos, se observa una alta incidencia de estenosis al utilizar injertos de Dacron, y un retraso quirúrgico en neonatos hasta que la vena cava inferior alcance un diámetro comparable al de su tamaño adulto final, debido al sobrecrecimiento somático del paciente. Dado las limitaciones mencionadas, se han explorado opciones alternativas diseñadas para minimizar la necesidad de múltiples intervenciones quirúrgicas y mejorar la calidad de vida de los pacientes.
Los pacientes con cardiopatía congénita (ACHD) e insuficiencia del ventrículo izquierdo (VI) sistémico suelen recibir tratamientos con medicamentos similares a los utilizados en la insuficiencia cardíaca adquirida. Estos incluyen betabloqueantes, inhibidores del sistema renina-angiotensina (como IECA, ARAII o inhibidores de angiotensina-neprilisina), antagonistas del receptor de mineralocorticoides, inhibidores del cotransportador de sodio-glucosa 2, diuréticos e incluso combinaciones de hidralazina y nitratos. Sin embargo, debido a que estos pacientes han sido históricamente excluidos de grandes ensayos clínicos, la evidencia sobre la efectividad de estos tratamientos en ACHD es limitada.
En pacientes con insuficiencia del ventrículo derecho (VD) sistémico, el uso de betabloqueantes como carvedilol y metoprolol ha mostrado algunos beneficios en la función ventricular y la tolerancia al ejercicio, aunque sin un impacto claro en la fracción de eyección. Otros tratamientos, como losartán y valsartán, han mostrado resultados mixtos en la mejora de la función ventricular derecha, mientras que los inhibidores de la enzima convertidora de angiotensina (IECA) no han demostrado beneficios significativos en la capacidad de ejercicio ni en la fracción de eyección.
En pacientes con circulación de Fontan, se ha explorado el uso de vasodilatadores pulmonares como sildenafil, bosentán e iloprost, con efectos variables en la función cardiovascular y el rendimiento en el ejercicio. Algunos estudios sugieren que los antagonistas del receptor de endotelina pueden ayudar a reducir la resistencia vascular pulmonar, especialmente en aquellos con niveles elevados. Para el síndrome de Eisenmenger, el tratamiento se enfoca en medidas de soporte, control de síntomas y el uso de vasodilatadores pulmonares cuando sea apropiado, aunque se debe evitar cualquier medicamento que reduzca demasiado la presión arterial y empeore la cianosis. En casos graves, el trasplante de corazón y pulmón sigue siendo una opción.
El manejo de ACHD con insuficiencia cardíaca requiere una evaluación individualizada, considerando las particularidades anatómicas y fisiológicas de cada paciente. El seguimiento y la efectividad de la medicación en ACHD presentan desafíos debido a la complejidad de estas condiciones. La respuesta a los medicamentos puede variar significativamente y, en algunos casos, las dosis deben ajustarse según parámetros como la función renal. Además, los pacientes con ACHD pueden presentar una mayor fragilidad, lo que puede influir en su tolerancia al tratamiento. En casos de insuficiencia cardíaca avanzada, el manejo hospitalario puede requerir el uso de medicamentos vasoactivos como norepinefrina y milrinona para estabilizar la función cardíaca. A medida que estos pacientes envejecen y desarrollan síntomas progresivos de insuficiencia cardíaca, es fundamental considerar terapias avanzadas, como el soporte circulatorio mecánico o el trasplante cardíaco, para mejorar los resultados clínicos.
Tratamiento farmacológico
La disfunción del nodo sinusal puede ser congénita o una complicación de cirugías previas. Se observa en pacientes con anomalías cardíacas congénitas, como la isomería auricular izquierda o la yuxtaposición del lado izquierdo de los apéndices auriculares. Además, puede surgir tras procedimientos como la cirugía de Fontan, el cambio auricular o la reparación de la tetralogía de Fallot. Igualmente, el bloqueo auriculoventricular (AV) puede ser congénito o surgir después de intervenciones quirúrgicas, como la reparación de defectos del tabique auriculoventricular o cirugías valvulares. En casos donde la bradicardia o el bloqueo AV afectan la calidad de vida o la función cardíaca, se recomienda la implantación de marcapasos. Algunos estudios han mostrado que en pacientes con cardiopatías congénitas que dependen en gran medida de la estimulación ventricular, puede desarrollarse una miocardiopatía asociada con la estimulación, aunque sin complicaciones graves asociadas con el uso de marcapasos sin cables.
La muerte súbita cardíaca es una de las principales causas de muerte en pacientes con cardiopatías congénitas. Para prevenirla, se indican desfibriladores automáticos implantables (DAI) en personas con disfunción del ventrículo izquierdo con fracción de eyección ≤35%, antecedentes de síncope inexplicado con sospecha de arritmia, o con factores de riesgo como taquicardia ventricular y ensanchamiento del complejo QRS. Pacientes con tetralogía de Fallot reparada, disfunción del ventrículo derecho o síndrome de Eisenmenger con buena condición funcional pueden beneficiarse de estos dispositivos. Los DAI también permiten la monitorización remota de arritmias auriculares, lo que facilita los ajustes en la terapia antiarrítmica. La elección del método de implantación, ya sea transvenoso o epicárdico, depende de la anatomía congénita y las cirugías previas del paciente.
La terapia de resincronización cardíaca (TRC) es una opción para mejorar la insuficiencia cardíaca en personas con cardiopatías congénitas que presentan disfunción ventricular y retraso en la conducción eléctrica del corazón. Se ha observado que la TRC mejora la capacidad funcional, reduce la duración del QRS y aumenta la fracción de eyección, con beneficios sostenidos a largo plazo. Incluso en pacientes de mayor edad con anatomías cardíacas complejas, la tasa de éxito es similar a la observada en personas con cardiopatías adquiridas. Además, estudios han demostrado que la TRC reduce la mortalidad en comparación con pacientes con miocardiopatía isquémica o no isquémica. La estimulación del sistema de conducción cardíaca, una alternativa más fisiológica, también ha mostrado mejoras significativas en la función ventricular, consolidando la TRC como una estrategia clave para el manejo de la insuficiencia cardíaca en pacientes con cardiopatías congénitas.
Tratamiento mediante el uso de dispositivos médicos
Referencias:
Pidaparti M, Geddes GC, Durbin MD. Clinical Genetic and Genomic Testing in Congenital Heart Disease and Cardiomyopathy. J Clin Med. 2024 Apr 26;13(9):2544.
Francisco-Pascual J, Mallofré Vila N, Santos-Ortega A, Rivas-Gándara N. Tachyarrhythmias in congenital heart disease. Front Cardiovasc Med. 2024 Jun 3;11:1395210.
Salih T, Caputo M, Ghorbel MT. Recent Advances in Hydrogel-Based 3D Bioprinting and Its Potential Application in the Treatment of Congenital Heart Disease. Biomolecules. 2024 Jul 18;14(7):861.
Meng X, Song M, Zhang K, Lu W, Li Y, Zhang C, Zhang Y. Congenital heart disease: types, pathophysiology, diagnosis, and treatment options. MedComm (2020). 2024 Jul 5;5(7):e631.
Carazo M. Medical Therapy for Heart Failure in Adult Congenital Heart Disease Patients. Struct Heart. 2024 Apr 10;8(4):100297.
Zhou Shifan , Liu Lu , Jin Xiaochuang , Dorikun Daniel , Ma Songfeng. Biomarkers predicting postoperative adverse outcomes in children with congenital heart disease: a systematic review and meta-analysis. Frontiers in Pediatrics. 2025. 13

(anuncios)