Descifrando el Parkinson: Del misterio de los cuerpos de Lewy a la medicina del futuro
José Hernández Jiménez
4/8/202534 min leer


Introducción al Parkinson: Una Enfermedad Neurodegenerativa Común
El Parkinson es la segunda enfermedad neurodegenerativa más frecuente, caracterizada por una progresión lenta y continua. Tradicionalmente, su diagnóstico se basaba en síntomas motores como temblores, rigidez y lentitud de movimientos, lo que significaba que la enfermedad solo podía identificarse en etapas avanzadas. Sin embargo, recientes avances en su fisiopatología han permitido la identificación de marcadores biológicos, lo que podría facilitar su detección temprana. Este enfoque podría revolucionar el tratamiento, permitiendo intervenir antes de la aparición de síntomas motores y modificando el curso de la enfermedad.
Historia y Descubrimientos Claves
Desde que James Parkinson describió la enfermedad de Parkinson en 1817, su comprensión ha evolucionado significativamente. Durante el siglo XX, se identificaron estructuras cerebrales afectadas, como la sustancia negra, y se descubrieron los cuerpos de Lewy, depósitos anormales de proteínas en las neuronas. En la década de 1960, se demostró que la enfermedad de Parkinson está relacionada con una deficiencia de dopamina en el cerebro, lo que llevó al desarrollo de la levodopa, el tratamiento más eficaz hasta la fecha. En la década de 1990, la identificación de la alfa-sinucleína como el principal componente de los cuerpos de Lewy y la detección de mutaciones genéticas asociadas a la enfermedad de Parkinson marcaron un hito en la investigación de la enfermedad.
Fases del Parkinson y Dificultades Diagnósticas
El Parkinson no es una enfermedad homogénea, lo que complica su diagnóstico y clasificación. Aunque tradicionalmente se define por síntomas motores, también incluye manifestaciones no motoras como alteraciones del sueño, depresión y problemas digestivos. Se ha propuesto que la enfermedad atraviesa tres fases: una fase preclínica, sin síntomas evidentes; una fase prodrómica, con signos sutiles como pérdida del olfato o trastornos del sueño; y la fase clínica, cuando aparecen los síntomas motores. Detectar la enfermedad en sus primeras etapas es clave para desarrollar tratamientos que puedan retrasar o prevenir la degeneración neuronal.
Factores de Riesgo: Genética y Medio Ambiente
El desarrollo del Parkinson se debe a una combinación de factores genéticos, ambientales y el envejecimiento. Si bien existen formas hereditarias, la mayoría de los casos son esporádicos y sin una causa clara. Se ha identificado que la exposición a pesticidas como el rotenone y el paraquat aumenta el riesgo de desarrollar la enfermedad, ya que afectan la función mitocondrial y generan estrés oxidativo. También se ha investigado la relación entre la acumulación de hierro en el cerebro y el Parkinson, aunque sigue siendo un tema de debate.
Estilo de Vida y Protección contra el Parkinson
Algunos hábitos pueden influir en la susceptibilidad a la enfermedad de Parkinson. La actividad física regular parece reducir el riesgo, posiblemente debido a su efecto sobre la función mitocondrial y la disminución del estrés oxidativo. Se ha observado que niveles elevados de urato en sangre podrían ser protectores, especialmente en los hombres. El consumo de café también se ha asociado con una menor incidencia de enfermedad de Parkinson, posiblemente debido a sus efectos neuroprotectores. Sin embargo, estos beneficios varían entre hombres y mujeres, lo que sugiere que factores hormonales también juegan un papel importante.
Perspectivas Futuras y Desarrollo de Tratamientos
El Parkinson es una enfermedad compleja con múltiples factores implicados en su desarrollo y progresión. Aunque la pérdida de neuronas dopaminérgicas es su característica central, también están involucrados procesos como el estrés oxidativo, la disfunción mitocondrial y la inflamación. La investigación actual se centra en el desarrollo de estrategias para detectar la enfermedad de Parkinson en sus fases iniciales y encontrar tratamientos que no solo alivien los síntomas, sino que puedan frenar o revertir la progresión del daño neuronal.
Entendiendo el Parkinson desde la Fisiopatología: De los Cuerpos de Lewy a la Genética
El parkinsonismo es un trastorno neurológico que afecta principalmente a los ganglios basales, un conjunto de estructuras cerebrales responsables de la regulación del movimiento. En la enfermedad de Parkinson, una de las formas más comunes de parkinsonismo, la pérdida de neuronas dopaminérgicas en la sustancia negra, una zona del cerebro, reduce la señalización hacia el cuerpo estriado, lo que afecta el control motor. Esto provoca síntomas característicos como rigidez, temblores y dificultad para iniciar los movimientos. Estos síntomas pueden interferir significativamente con la vida diaria de los pacientes.
Además de la pérdida de dopamina, investigaciones han demostrado que otras áreas cerebrales también se ven afectadas en la enfermedad de Parkinson. Por ejemplo, la degeneración en el locus coeruleus y el núcleo del rafe se asocia con síntomas no motores como depresión y fatiga. También se ha observado que la alteración de las vías colinérgicas contribuye al desarrollo de demencia en la enfermedad de Parkinson. Esta complejidad sugiere que la enfermedad no afecta únicamente al sistema motor, sino que involucra un panorama neurobiológico más amplio.
Mecanismos patológicos y conexión con otras áreas del cerebro
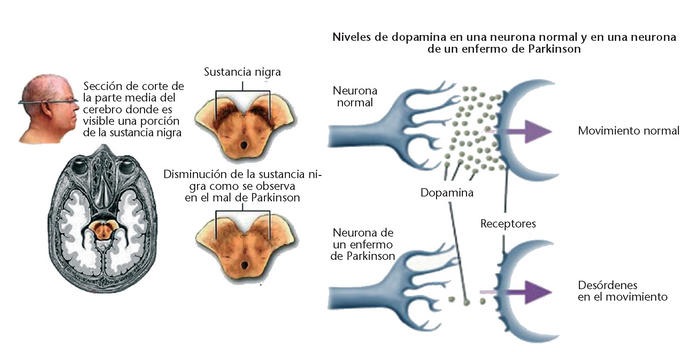
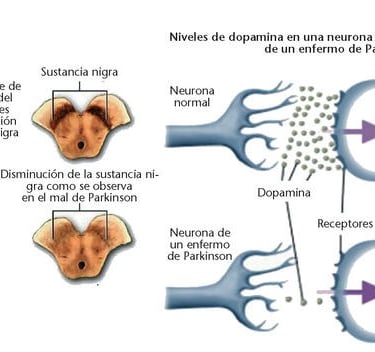
Imagen: meetgenes.blogs.uv.es
(publicidad)
Uno de los rasgos distintivos de la enfermedad de Parkinson es la presencia de cuerpos de Lewy, que están compuestos principalmente por la proteína α-sinucleína. En su forma normal, esta proteína participa en la comunicación entre neuronas. Sin embargo, en la enfermedad de Parkinson, la α-sinucleína adopta una estructura anómala que favorece su acumulación y propagación por el cerebro. Este proceso se asemeja al mecanismo de enfermedades priónicas. Se ha propuesto que la enfermedad de Parkinson podría comenzar en la mucosa intestinal o el bulbo olfatorio, extendiéndose luego al cerebro a través del nervio vago, aunque no todos los casos siguen esta progresión.
El papel de los cuerpos de Lewy y la α-sinucleína
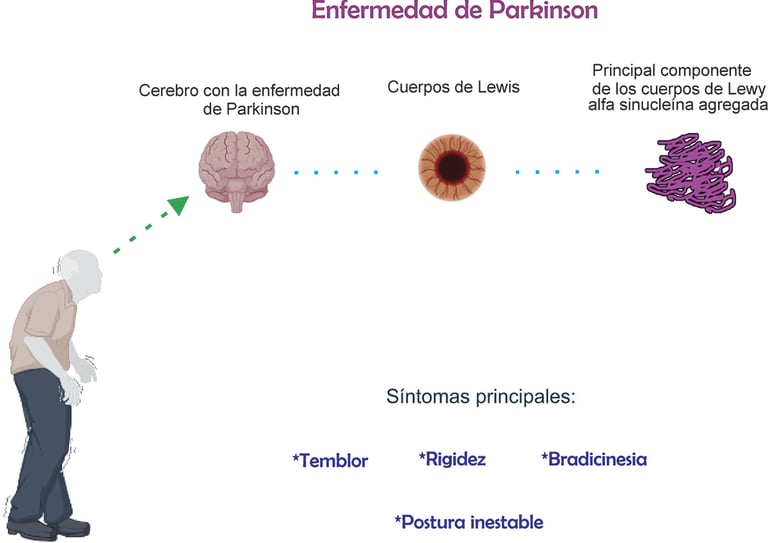
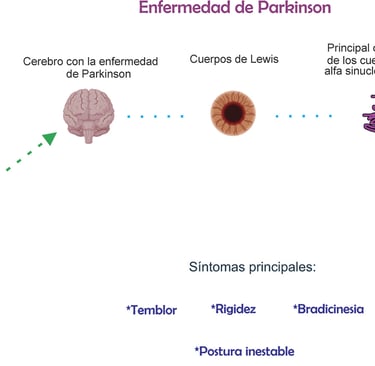
Imagen: avanceyperspectiva.cinvestav.mx
Contribución de proteínas adicionales en la EP
Además de la α-sinucleína, otras proteínas como la β-amiloide y la tau, comúnmente asociadas con la enfermedad de Alzheimer, también pueden estar presentes en la enfermedad de Parkinson, especialmente en casos donde se presenta demencia. Esta interacción entre diferentes proteínas sugiere que la enfermedad de Parkinson es una enfermedad heterogénea, en la que múltiples factores contribuyen a su desarrollo y las diferentes manifestaciones clínicas que se observan en los pacientes.
Síntomas Motores y No Motores de la Enfermedad de Parkinson
La enfermedad de Parkinson es el segundo trastorno neurodegenerativo más frecuente después del Alzheimer y la principal enfermedad del movimiento a nivel mundial. Su incidencia aumenta con la edad y es aproximadamente el doble de común en hombres que en mujeres. Aunque es poco frecuente antes de los 50 años, su prevalencia crece significativamente en poblaciones de mayor edad.
Los síntomas de la enfermedad de Parkinson se dividen en motores y no motores. Entre los síntomas motores destacan la bradicinesia (movimientos lentos y reducidos), la rigidez muscular, el temblor en reposo y la inestabilidad postural. La bradicinesia es el signo más característico de la enfermedad de Parkinson y se manifiesta como una dificultad progresiva para realizar movimientos voluntarios.
Los síntomas no motores incluyen deterioro cognitivo, disfunción autonómica (como estreñimiento y presión arterial baja al ponerse de pie), trastornos del sueño, depresión y alteraciones en el sentido del olfato. Estos síntomas pueden aparecer incluso antes de los motores y afectan considerablemente la calidad de vida de los pacientes.
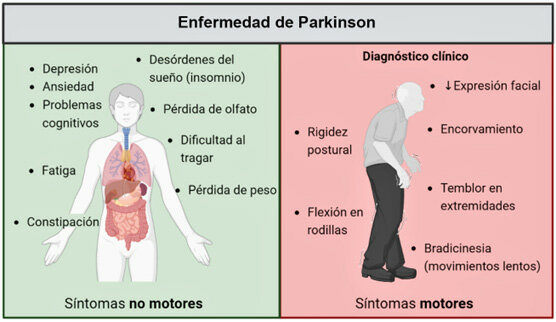
Imagen: Padilla-Godínez et al. ¿Qué hay de nuevo en la búsqueda para tratar la enfermedad de Parkinson? 2023. Revista Digital Universitaria 24(4)
Etiopatogenia
Desde el punto de vista neuropatológico, la enfermedad de Parkinson se caracteriza por la degeneración progresiva de las neuronas dopaminérgicas en la sustancia negra del cerebro, lo que provoca una disminución en la producción de dopamina, un neurotransmisor clave para el control del movimiento. También se observa la acumulación de cuerpos de Lewy, inclusiones intracelulares compuestas principalmente por la proteína α-sinucleína mal plegada.
Se han identificado varios mecanismos involucrados en la degeneración neuronal en la enfermedad de Parkinson. Entre ellos, destacan la disfunción mitocondrial, la acumulación de proteínas mal plegadas, el estrés oxidativo y la inflamación crónica.
La autofagia, un proceso celular encargado de la degradación y reciclaje de proteínas dañadas y orgánulos defectuosos, juega un papel crucial en la enfermedad de Parkinson. Se ha propuesto que un déficit en la autofagia contribuye a la acumulación de α-sinucleína y otras proteínas tóxicas, lo que favorece la neurodegeneración.
Estudios recientes han identificado mutaciones en genes involucrados en la autofagia, como ATG5, ATG7, ATG12 y ATG16L1, que podrían aumentar el riesgo de desarrollar la enfermedad. Sin embargo, se necesitan más investigaciones para confirmar su papel en la patogénesis de la enfermedad de Parkinson.
Genética en la Enfermedad de Parkinson
Si bien la mayoría de los casos de enfermedad de Parkinson son esporádicos, aproximadamente el 5% tienen un origen genético identificado. Se han descubierto varios genes implicados en la enfermedad, algunos de los cuales siguen un patrón de herencia monogénica, mientras que otros solo aumentan el riesgo de desarrollarla con el envejecimiento.
Genes más destacdos
SNCA
El primer gen asociado con la Enfermedad de Parkinson fue SNCA, que codifica la proteína α-sinucleína. Las mutaciones en este gen provocan una acumulación anómala de la proteína, lo que favorece la formación de agregados tóxicos en las neuronas. Estos agregados interfieren con la eliminación de proteínas defectuosas y contribuyen a la neurodegeneración.
LRRK2
El gen LRRK2 codifica una quinasa involucrada en múltiples procesos celulares, como el tráfico vesicular y la inflamación neuronal. Algunas variantes aumentan su actividad, lo que promueve la acumulación de proteínas mal plegadas y agrava el daño neuronal.
Curiosamente, aunque LRRK2 se expresa en el cerebro, su mayor expresión se encuentra en células del sistema inmunológico, como microglías y astrocitos. Esto sugiere un posible papel de la inflamación en la progresión de la enfermedad de Parkinson.
PRKN (Parkina)
El gen PRKN es el más comúnmente asociado con la enfermedad de Parkinson de inicio temprano. Su proteína, Parkina, participa en la eliminación de proteínas dañadas y mitocondrias defectuosas. Las mutaciones en este gen reducen su actividad, lo que favorece la acumulación de proteínas anormales y la disfunción mitocondrial.
PINK1
PINK1 codifica una quinasa mitocondrial que protege a las células del estrés oxidativo. En condiciones normales, coopera con Parkina para eliminar mitocondrias dañadas. Las mutaciones en PINK1 interrumpen este proceso y contribuyen a la degeneración neuronal.
VPS35 y VPS13C
El gen VPS35 forma parte del complejo retromero, que regula el transporte y reciclaje de proteínas dentro de la célula. Las variantes en VPS35 pueden afectar su función, alterando la degradación de proteínas y la homeostasis mitocondrial.
Por otro lado, VPS13C también está involucrado en la regulación mitocondrial. Se ha observado que mutaciones en este gen pueden provocar una progresión más rápida de la enfermedad de Parkinson, con deterioro cognitivo temprano y acumulación difusa de cuerpos de Lewy.
GBA1
GBA1 es el factor genético de riesgo más importante para la enfermedad de Parkinson. Este gen codifica la enzima glucocerebrosidasa, que degrada ciertos lípidos en los lisosomas. Variantes en GBA1 reducen la actividad de esta enzima, lo que afecta la eliminación de α-sinucleína y favorece su acumulación en las neuronas.
Los portadores de mutaciones en GBA1 suelen presentar un inicio más temprano de la enfermedad, una progresión más rápida y un mayor riesgo de deterioro cognitivo y disautonomía.
De la Biología a la Clínica: Avances en la Comprensión y Diagnóstico del Parkinson
Evaluación y Clasificación del Dolor en la Enfermedad de Parkinson
El dolor es un síntoma frecuente en la enfermedad de Parkinson y se evalúa mediante cuestionarios clínicos. La King’s Parkinson’s Disease Pain Scale es la única escala específicamente diseñada para medir el dolor en estos pacientes, mientras que otras herramientas, como el Parkinson’s Disease Questionnaire y la MDS-Unified Parkinson’s Disease Rating Scale, también pueden ser útiles. Además, se emplean escalas que miden aspectos relacionados con el dolor, como el Parkinson’s Disease Sleep Scale-2, la Fatigue Severity Scale y las escalas de ansiedad y depresión de Hamilton. También existen herramientas neurofisiológicas, como estímulos eléctricos o térmicos y potenciales evocados por láser, que han demostrado una reducción en los umbrales de dolor en pacientes con enfermedad de Parkinson en comparación con personas sanas.
La clasificación del dolor en la enfermedad de Parkinson es un desafío, ya que no existe un consenso universal. Un método ampliamente utilizado es el propuesto por Wasner y Deuschl, que divide el dolor en cuatro niveles. En el primer nivel, se distingue entre dolor relacionado o no con la enfermedad de Parkinson. Luego, se clasifica en nociceptivo o neuropático, o en una categoría mixta cuando la distinción no es clara. Posteriormente, el dolor se clasifica según su localización en musculoesquelético, visceral, cutáneo, periférico o central. Finalmente, se consideran aspectos clínicos y terapéuticos específicos. Otro enfoque común es el de Ford, que distingue entre cinco tipos de dolor: musculoesquelético, distónico, neuropático/radicular, central/primario y acatisia.
Dolor Musculoesquelético
El dolor musculoesquelético es el más frecuente en la enfermedad de Parkinson y se debe principalmente a la rigidez muscular, la postura anormal y los trastornos en la marcha. Afecta con mayor frecuencia la columna vertebral, el cuello, los tobillos, las caderas y los hombros, siendo este último de especial interés debido a su asociación con el síntoma inicial del "hombro congelado". La aparición de este tipo de dolor suele estar vinculada a la progresión de la enfermedad y a las alteraciones en la movilidad del paciente.
Dolor Distónico
El dolor distónico es una de las manifestaciones más intensas y debilitantes de la enfermedad de Parkinson. Se debe a contracciones musculares involuntarias que pueden provocar posturas anormales y, en algunos casos, dislocaciones articulares. Las regiones más afectadas incluyen las extremidades y la cara. Puede presentarse de manera espontánea o en asociación con el movimiento y suele ser una complicación del tratamiento dopaminérgico, apareciendo con mayor frecuencia en los periodos OFF, cuando los efectos de la medicación disminuyen. En otros casos, se manifiesta durante los picos de concentración del fármaco o como una disquinesia distónica.
Dolor Neuropático y Dolor Central
El dolor neuropático en la enfermedad de Parkinson puede presentarse como dolor radicular o neuropatía periférica. El dolor radicular suele estar relacionado con deformaciones posturales y la inmovilidad prolongada, mientras que la neuropatía periférica puede deberse a deficiencias de vitamina B12 o la acumulación de sustancias neurotóxicas. Este tipo de dolor suele acompañarse de sensaciones de hormigueo o entumecimiento en las áreas afectadas.
Por otro lado, el dolor central es difícil de describir y puede manifestarse como sensación de ardor, pinchazos o presión intensa. Suele aparecer en la extremidad más afectada por la enfermedad, aunque también puede sentirse en el abdomen, el pecho o incluso en regiones genitales.
Acatisia
La acatisia es una manifestación relacionada con la deficiencia dopaminérgica que causa una sensación de inquietud extrema y la necesidad constante de moverse. Aunque no es un dolor en sí mismo, puede ser un síntoma altamente incapacitante, afectando la calidad de vida del paciente. Se diferencia de otros trastornos motores, como la disquinesia y el síndrome de piernas inquietas, por su persistencia y por su estrecha relación con los periodos OFF de la enfermedad de Parkinson.
(publicidad)
El Futuro del Diagnóstico del Parkinson: IA, Genética y Evaluaciones Clínicas de Precisión
Su diagnóstico representa un desafío debido a la ausencia de biomarcadores definitivos, lo que hace que se base principalmente en criterios clínicos. A pesar de los avances en la comprensión de su fisiopatología, la identificación temprana sigue siendo una necesidad insatisfecha. En este contexto, el desarrollo de herramientas diagnósticas basadas en genética e inteligencia artificial ha cobrado relevancia, facilitando una detección más precisa y temprana de la enfermedad de Parkinson.
Diagnóstico clínico
El diagnóstico clínico del Párkinson se basa en la identificación de signos motores característicos, como bradicinesia, rigidez y temblor en reposo. Estos síntomas deben ser evaluados mediante exploración neurológica detallada y escalas estandarizadas, como la Unified Parkinson's Disease Rating Scale (UPDRS).
La bradicinesia es el signo más característico y se manifiesta como una disminución progresiva de la velocidad y amplitud del movimiento. La rigidez se percibe como una resistencia al movimiento pasivo de las extremidades, mientras que el temblor en reposo, que suele comenzar asimétricamente, es un signo distintivo de la enfermedad. Otros síntomas motores incluyen inestabilidad postural y alteraciones en la marcha.
Además de los síntomas motores, los pacientes pueden presentar manifestaciones no motoras como trastornos del sueño, deterioro cognitivo, trastornos neuropsiquiátricos como depresión y ansiedad, así como disautonomía. Estos signos pueden preceder a los síntomas motores por varios años, sugiriendo que el Párkinson es una enfermedad sistémica y no exclusivamente un trastorno del movimiento.
Dado que no existe una prueba diagnóstica definitiva, se recomienda el uso de estudios de neuroimagen funcional, como la tomografía por emisión de positrones (PET) y la tomografía computarizada por emisión de fotón único (SPECT). Estas pruebas pueden ayudar a diferenciar el Párkinson de otros parkinsonismos atípicos y trastornos neurológicos con síntomas similares. Asimismo, la resonancia magnética (RM) puede ser utilizada para descartar otras patologías que cursen con síntomas similares.
Diagnóstico genético
La investigación en genética ha revelado que ciertas mutaciones pueden predisponer al desarrollo del Párkinson. Se han identificado genes como LRRK2, SNCA, PARK2, PINK1, DJ-1 y GBA, que están implicados en su fisiopatología. Aunque la mayoría de los casos son esporádicos, se estima que entre un 5% y un 10% tienen un componente hereditario.
El análisis genético permite la detección de variantes patogénicas en individuos con antecedentes familiares o en poblaciones específicas con mayor riesgo. Este tipo de diagnóstico es especialmente relevante en la investigación de terapias personalizadas y en la estratificación de pacientes para ensayos clínicos. Sin embargo, la presencia de una mutación no garantiza el desarrollo de la enfermedad, lo que subraya la importancia de factores ambientales y epigenéticos.
El uso de técnicas de secuenciación masiva ha facilitado el estudio de paneles génicos asociados al Párkinson, permitiendo una mayor comprensión de su heterogeneidad. Además, los estudios de asociación del genoma completo (GWAS) han identificado variantes de riesgo en genes previamente no relacionados con la enfermedad, ampliando el conocimiento sobre su etiología. La combinación de estudios genómicos con análisis epigenéticos está permitiendo entender mejor la interacción entre el ambiente y la susceptibilidad genética.
Uso de la inteligencia artificial en el diagnóstico del Párkinson
Los avances en inteligencia artificial (IA) han permitido el desarrollo de herramientas capaces de mejorar la precisión diagnóstica del Párkinson. Mediante algoritmos de aprendizaje automático, es posible analizar grandes volúmenes de datos clínicos, genéticos y de neuroimagen para detectar patrones característicos de la enfermedad.
Las técnicas de procesamiento del lenguaje natural (NLP) han demostrado ser útiles en la evaluación de alteraciones en el habla, mientras que los sensores de movimiento y wearables permiten monitorear la progresión de los síntomas motores con mayor precisión. Además, modelos de IA aplicados a datos de neuroimagen han mejorado la detección de cambios estructurales en el cerebro asociados al Párkinson.
El empleo de redes neuronales para analizar patrones en electroencefalogramas y registros de actividad motora ha permitido la identificación de biomarcadores digitales, facilitando un diagnóstico más objetivo. Esto es particularmente relevante en etapas tempranas de la enfermedad, cuando los síntomas pueden ser sutiles y fácilmente confundidos con otros trastornos.
A pesar de estos avances, el uso de IA en el diagnóstico del Párkinson aún enfrenta desafíos, como la necesidad de bases de datos extensas y bien curadas, así como la interpretabilidad de los modelos. Sin embargo, su integración con métodos convencionales promete mejorar la precisión diagnóstica y facilitar una intervención temprana, mejorando la calidad de vida de los pacientes.
Innovación en el tratamiento en la enfermedad de Parkinson: del presente al futuro
Como se ha dicho anteriormente, la enfermedad de Parkinson es un trastorno neurodegenerativo caracterizado por la pérdida progresiva de neuronas dopaminérgicas en el cerebro, lo que provoca síntomas motores y no motores que afectan significativamente la calidad de vida de los pacientes. A lo largo de los años, se han explorado diversas estrategias para restaurar la función dopaminérgica y mejorar los síntomas. Uno de los enfoques más estudiados ha sido el trasplante de células para reemplazar las neuronas perdidas. Inicialmente, se utilizaron células obtenidas de tejido mesencefálico fetal implantadas en el cerebro de pacientes con enfermedad de Parkinson, pero los resultados fueron variables debido a factores como la calidad del injerto y la respuesta inmune. Además, algunos pacientes desarrollaron movimientos involuntarios anormales (discinesias), lo que llevó a la interrupción de estos estudios. En la actualidad, la investigación se enfoca en alternativas como el uso de células madre pluripotentes inducidas (iPSCs), que pueden derivarse de células adultas y transformarse en neuronas dopaminérgicas, lo que ofrece una opción más accesible y ética, aunque aún presenta desafíos, como el riesgo de rechazo inmunológico.
Otra línea de investigación prometedora es la terapia génica, que busca modificar la actividad de las neuronas mediante la introducción de material genético. Para ello, se han desarrollado vectores virales avanzados, como los basados en el virus adenoasociado (AAV), que permiten llevar genes terapéuticos al cerebro de manera más precisa y segura. Estos avances han posibilitado ensayos clínicos con factores neurotróficos, como el GDNF, que favorecen la supervivencia neuronal. También se han explorado métodos menos invasivos, como la administración intranasal de nanopartículas y células madre. En paralelo, los modelos experimentales de la enfermedad han evolucionado, pasando de modelos animales clásicos a cultivos tridimensionales de células derivadas de pacientes, que replican mejor las características de la enfermedad de Parkinson y permiten probar nuevos tratamientos con mayor precisión.
Si bien la mayoría de los esfuerzos se han centrado en aliviar los síntomas motores, los síntomas neuropsiquiátricos de la enfermedad de Parkinson, como la depresión, la ansiedad y la psicosis, continúan siendo un desafío. El tratamiento de estos síntomas requiere un enfoque multidisciplinario que combine estrategias farmacológicas y no farmacológicas. Se ha demostrado que ciertos antidepresivos, como los inhibidores de la recaptación de serotonina y noradrenalina, son eficaces y bien tolerados, mientras que las terapias psicológicas, como la terapia cognitivo-conductual, han mostrado beneficios incluso cuando se administran a distancia. También se han explorado tratamientos complementarios, como la estimulación magnética transcraneal y el ejercicio, que podrían ayudar a mejorar el bienestar de los pacientes. En el caso de la psicosis, el manejo implica reducir la carga de medicamentos cuando es posible y recurrir a fármacos como pimavanserina, un antipsicótico con un perfil de seguridad favorable. A medida que avanza la investigación, surgen nuevas estrategias para abordar tanto los síntomas motores como los no motores, con el objetivo de ofrecer tratamientos más eficaces y personalizados.
Tratamiento de síntomas motores y no motores
El enfoque tradicional para tratar la enfermedad de Parkinson suele comenzar con una estrategia farmacológica de reemplazo de dopamina, utilizando carbidopa/levodopa o agonistas dopaminérgicos, mientras que algunos medicamentos prolongan la vida de la dopamina endógena. Además de estos tratamientos, muchas personas con enfermedad de Parkinson recurren a la medicina complementaria e integrativa para mejorar la salud cerebral y general. Los cambios en el estilo de vida, como el ejercicio aeróbico intenso, pueden ofrecer beneficios neuroprotectores y mejorar la calidad de vida. Dado que la enfermedad de Parkinson es una enfermedad compleja con síntomas y progresiones variables entre los pacientes, el tratamiento debe adaptarse a cada caso e incluir el manejo tanto de síntomas motores como no motores. Un enfoque integral combina tratamientos tradicionales y alternativos con un programa inicial de rehabilitación para evaluar la enfermedad antes de considerar otras opciones, incluyendo la cirugía en casos en los que la enfermedad no responde a otros tratamientos. Este enfoque se basa en cinco estrategias terapéuticas clave: rehabilitación, terapia, neuroprotección, ralentización y cirugía, todas respaldadas por estudios en humanos o modelos animales.
Rehabilitación como tratamiento en la Enfermedad del Parkinson
Antes de iniciar un tratamiento farmacológico para la enfermedad de Parkinson, los especialistas suelen recomendar que los pacientes consulten con un fisioterapeuta, un terapeuta ocupacional o un especialista en patología del habla. El objetivo de estas consultas es abordar algunos de los síntomas motores afectados por la enfermedad. La reducción de dopamina en la enfermedad de Parkinson suele provocar una disminución en la intensidad de la voz y una limitación en los movimientos corporales. Para contrarrestar estos efectos, existen programas como LSVT-LOUD y LSVT-BIG, diseñados para ayudar a los pacientes a hablar con mayor volumen y realizar movimientos más amplios. La mayoría de las personas con enfermedad de Parkinson experimentan dificultades en el habla y la voz que afectan negativamente su comunicación. LSVT-LOUD mejora la proyección vocal, la articulación y la entonación, lo que facilita la comunicación funcional. Por otro lado, LSVT-BIG utiliza ejercicios intensivos de movimientos amplios para contrarrestar la lentitud (bradicinesia) y la reducción en la amplitud de los movimientos (hipocinesia), lo que permite movimientos más grandes, rápidos y precisos. Estos programas deben ser dirigidos por especialistas certificados y se realizan en sesiones de una hora, cuatro veces por semana, durante cuatro semanas. Posteriormente, los pacientes pueden continuar los ejercicios por su cuenta.
La rehabilitación en la enfermedad de Parkinson requiere un enfoque continuo basado en el ejercicio regular. Los síntomas motores, como la rigidez, el deterioro del equilibrio y la lentitud en los movimientos, pueden manejarse con un plan de ejercicio supervisado por un neurólogo especializado en trastornos del movimiento. Este plan debe incluir estiramientos, fortalecimiento muscular, entrenamiento de movimiento y ejercicios aeróbicos. Existen numerosos fisioterapeutas capacitados en rutinas específicas para la enfermedad de Parkinson y diversas modalidades de ejercicio que han demostrado mejorar la calidad de vida de los pacientes. Algunas de estas opciones incluyen programas como PWR!Moves, Rock Steady Boxing y Dance for PD, así como caminar con bastones, andar en bicicleta estática, practicar tai chi o yoga. Debido a sus beneficios, la terapia de rehabilitación debería ser parte del manejo de la enfermedad de Parkinson en todas sus etapas.
Opciones terapéuticas para el tratamiento de los síntomas motores de la Enfermedad del Parkinson
La dopamina es un neurotransmisor clave en el sistema nervioso central, que tiene la estructura química de 3,4-dihidroxi-feniletilamina y pertenece a las familias moleculares de las catecolaminas y las fenetilaminas. Este compuesto es un derivado del aminoácido tirosina, el cual, mediante la acción de la enzima tirosina hidroxilasa, se convierte en levodopa (L-DOPA). Luego, la enzima DOPA descarboxilasa elimina dióxido de carbono de L-DOPA para producir dopamina. La dopamina juega un papel esencial en la transmisión de señales en el cerebro y otras partes del sistema nervioso, lo que la convierte en una pieza clave en muchas funciones corporales, incluidas las relacionadas con el movimiento y el estado de ánimo.
En el tratamiento de la enfermedad de Parkinson, que es principalmente un trastorno de deficiencia de dopamina, el reemplazo de dopamina sigue siendo la estrategia terapéutica principal. Una de las formas más comunes de tratamiento es la combinación de levodopa con carbidopa. La carbidopa es un inhibidor de la enzima que normalmente convertiría la levodopa en dopamina fuera del cerebro, lo que permite que la levodopa llegue de manera más efectiva al cerebro para su conversión en dopamina. Aunque esta combinación proporciona un alivio significativo de los síntomas motores, su uso prolongado puede generar efectos secundarios, como discinesia y fluctuaciones en la efectividad del tratamiento, conocidas como períodos "on-off".
Existen otros tratamientos complementarios para regular la dopamina en el cerebro, como los agonistas de dopamina, que imitan la acción de la dopamina al unirse a sus receptores en el sistema nervioso. Estos medicamentos pueden usarse solos o en combinación con levodopa para estabilizar los efectos del tratamiento a largo plazo. Por otro lado, los inhibidores de la monoaminooxidasa B (MAO-B) y los inhibidores de la catecol-O-metiltransferasa (COMT) ayudan a aumentar la disponibilidad de levodopa en el cerebro al ralentizar su degradación. Además, el medicamento amantadina, originalmente utilizado como antiviral, ha demostrado ser útil para controlar los síntomas motores de la enfermedad de Parkinson, particularmente el temblor y las discinesias inducidas por levodopa. Estos tratamientos ofrecen opciones valiosas para manejar los síntomas de la enfermedad de Parkinson, aunque cada uno tiene sus propios efectos secundarios y limitaciones.
Opciones terapéuticas para el tratamiento de los síntomas no motores de la Enfermedad del Parkinson
La enfermedad de Parkinson puede considerarse también un trastorno neuropsiquiátrico debido a los síntomas emocionales y cognitivos que la acompañan. Los problemas neuropsiquiátricos, como la apatía, la depresión y la ansiedad, son comunes en personas con enfermedad de Parkinson y suelen aparecer incluso en las primeras etapas de la enfermedad, a veces antes de que los síntomas motores se manifiesten. Estos síntomas no motores están relacionados con una reducción de la producción de dopamina, lo que afecta tanto a las funciones motoras como no motoras del paciente. Además, los efectos secundarios derivados del tratamiento dopaminérgico pueden incluir adicción, hipomanía y conductas como la hiperactividad nocturna y el punding, lo que añade complejidad en la gestión de los pacientes.
El manejo de los síntomas no motores de la enfermedad de Parkinson es complicado para los médicos, ya que deben distinguir entre los efectos del tratamiento, el progreso de la enfermedad y el estado emocional del paciente. La depresión, que afecta hasta al 50% de los pacientes con enfermedad de Parkinson en algún momento de la enfermedad, se trata generalmente con antidepresivos, especialmente los inhibidores selectivos de la recaptación de serotonina e inhibidores de la recaptación de serotonina y noradrenalina. En cuanto a la ansiedad, que se presenta con síntomas como preocupación excesiva, pánico y nerviosismo, también se puede tratar con fármacos, como los inhibidores selectivos de la recaptación de serotonina y la buspirona, además de terapia psicológica.
Otro síntoma común en pacientes con enfermedad de Parkinson es la sialorrea, o salivación excesiva, que no se debe a la producción excesiva de saliva, sino a la dificultad para tragarla debido a la lentitud en el reflejo de la deglución. Las opciones de tratamiento incluyen gotas de atropina, toxina botulínica y anticolinérgicos orales como el glicopirrolato. La constipación también es frecuente en pacientes con enfermedad de Parkinson, y se recomienda mantener una dieta adecuada, rica en fibra, y una correcta hidratación para prevenirla. Sin embargo, ciertos medicamentos, como el Reglan o el Compazine, deben evitarse, ya que son compuestos bloqueadores de dopamina.
Los trastornos cognitivos, como el deterioro leve que progresa a demencia, son una preocupación importante en los pacientes con enfermedad de Parkinson. Los inhibidores de la acetilcolinesterasa, como el donepezil, galantamina y rivastigmina, se utilizan comúnmente para tratar el deterioro cognitivo. En los casos en los que se desarrollan alucinaciones visuales o delirios, se pueden utilizar fármacos como el pimavanserin, clozapina y quetiapina. Además, los trastornos del sueño, como el insomnio y el comportamiento de sueño en la fase de movimientos oculares rápidos, son comunes en la enfermedad de Parkinson. Estos trastornos suelen ir acompañados de somnolencia diurna excesiva y apnea obstructiva del sueño. Por último, la hipotensión ortostática, que provoca una caída significativa de la presión arterial al ponerse de pie, y los problemas urinarios, como la incontinencia y la urgencia, son otros síntomas no motores que requieren un manejo especializado
Opciones neuroprotectoras para tratar la Enfermedad del Parkinson
Un objetivo clave en cualquier estrategia de tratamiento para la enfermedad de Parkinson es lograr algún tipo de neuroprotección. Entre los compuestos terapéuticos más destacados se encuentran la Selegilina y la Rasagilina, que han mostrado evidencia de efectos neuroprotectores en modelos celulares y en roedores con enfermedad de Parkinson. Sin embargo, en estudios clínicos como el DATATOP, se observó que, aunque la Selegilina ofreció un pequeño beneficio sintomático, no fue clasificada como verdaderamente neuroprotectora. Por su parte, la Rasagilina fue estudiada en grandes ensayos clínicos de seguimiento, pero la FDA no aprobó su etiquetado como tratamiento neuroprotector, lo que mantiene abierta la pregunta sobre su efectividad a largo plazo en términos de neuroprotección.
Por otro lado, el ejercicio ha ganado atención como una posible terapia neuroprotectora en la enfermedad de Parkinson. Se ha demostrado que el ejercicio puede reducir la neuroinflamación, un factor que contribuye al avance de la enfermedad. En estudios realizados con modelos animales, el ejercicio aeróbico intenso ayudó a preservar las neuronas dopaminérgicas restantes y promovió un aumento en los factores neurotróficos y una disminución de los marcadores inflamatorios. Estos hallazgos sugieren que el ejercicio no solo tiene efectos locales en el cerebro, sino que también puede tener beneficios sistémicos, promoviendo propiedades antioxidantes y antiinflamatorias. Los estudios en humanos han demostrado que el ejercicio moderado mejora la calidad de vida de las personas con Parkinson, mientras que el ejercicio aeróbico intenso parece tener un efecto neuroprotector. Además, la investigación sobre los "exerkines", sustancias producidas por el ejercicio, sugiere que estas podrían cruzar la barrera hematoencefálica y ofrecer protección contra la enfermedad de Parkinson y otras enfermedades neurodegenerativas.
Opciones para ralentizar la progresión de la Enfermedad de Parkinson
Actualmente, no existe ninguna terapia o tratamiento farmacológico conocido que haya demostrado ralentizar el progreso de la enfermedad de Parkinson, excepto el ejercicio aeróbico intenso. Ante la falta de opciones neuroprotectoras, muchas personas con enfermedad de Parkinson han recurrido a estrategias de medicina complementaria y alternativa e integrativa. Estas estrategias buscan preservar las neuronas dopaminérgicas restantes y, al mismo tiempo, reducir la neuroinflamación, lo que podría evitar que la enfermedad avance más. Entre los enfoques que se están explorando, se encuentra el impacto de ciertos compuestos que podrían ser beneficiosos para el mantenimiento de la enfermedad de Parkinson. Por ejemplo, la deficiencia de vitamina D3 se asocia con un peor funcionamiento motor y mayor severidad de la enfermedad, mientras que niveles más altos de vitamina D3 parecen mejorar el rendimiento cognitivo y la memoria verbal en personas con enfermedad de Parkinson. Otros compuestos, como el magnesio L-treonato, han demostrado atravesar la barrera hematoencefálica y podrían ayudar a la supervivencia de las células dopaminérgicas, mientras que la vitamina B1 es crucial para la salud de las neuronas y el apoyo cognitivo.
En cuanto a otras sustancias de interés, la taurina ha mostrado efectos positivos al regular las células microgliales proinflamatorias en modelos de ratón con enfermedad de Parkinson. El objetivo final de la terapia medicina complementaria y alternativa es preservar la salud de las células dopaminérgicas restantes. Algunos compuestos con propiedades antioxidantes, como la curcumina, ayudan a inhibir procesos inflamatorios y protegen contra el daño por radicales libres. Otros, como el ácido alfa-lipoico y la acetil-L-carnitina, han demostrado restaurar parcialmente la función mitocondrial y reducir la vulnerabilidad a la oxidación en estudios con ratones envejecidos, lo que sugiere que pueden ser beneficiosos para la población envejecida. Además, el NAC, un precursor del antioxidante glutatión, ayuda a reducir el estrés oxidativo en el cerebro. El trans-resveratrol también actúa como antioxidante y protege contra los radicales libres, mientras que la melatonina no solo regula el ciclo de sueño-vigilia, sino que también protege las mitocondrias. Estos compuestos, en conjunto, podrían contribuir a preservar las neuronas dopaminérgicas en el cerebro de las personas con enfermedad de Parkinson.
Tratamiento quirúrgico de la Enfermedad de Parkinson
La estimulación cerebral profunda (DBS) es una cirugía utilizada para tratar la enfermedad de Parkinson, especialmente en pacientes que sufren complicaciones a largo plazo debido al tratamiento con carbidopa/levodopa. Esta intervención se considera reversible, ya que no destruye el tejido cerebral, y la estimulación puede ajustarse conforme la enfermedad avanza. Además, se puede realizar de manera bilateral sin un aumento significativo en los efectos adversos. Con el refinamiento de la técnica de estimulación cerebral profunda, se ha mejorado la comprensión de la conexión entre los ganglios basales y la fisiopatología de la enfermedad de Parkinson. La cirugía suele dirigirse a tres estructuras cerebrales específicas: el tálamo, el globo pálido y el núcleo subtalámico. Los pacientes con enfermedad de Parkinson que presentan complicaciones motoras no controladas con medicamentos son los más indicados para esta cirugía, especialmente cuando el tratamiento con carbidopa/levodopa aún tiene un buen efecto, pero se ve acompañado por una excesiva discinesia.
(publicidad)
Uso de células madre mesenquimales como terapia en la Enfermedad de Parkinson
Las células madre mesenquimales (CMMs) representan una de las estrategias terapéuticas más prometedoras dentro del enfoque regenerativo y neuroprotector para tratar enfermedades neurodegenerativas. Estas células, obtenidas a partir de tejidos como la médula ósea, el tejido adiposo o el cordón umbilical, tienen una notable capacidad de autorrenovación y diferenciación, además de poseer propiedades inmunomoduladoras y antiinflamatorias.
En el contexto del Parkinson, las CMMs han demostrado una notable capacidad para liberar factores tróficos y bioactivos que favorecen la supervivencia y regeneración neuronal. Estas sustancias pueden estimular la plasticidad sináptica, promover la diferenciación de células madre endógenas y reducir el entorno neurotóxico presente en el cerebro afectado.
Una de las funciones más destacadas de las CMMs es su potencial para reducir el estrés oxidativo, un proceso implicado en el daño progresivo de las neuronas dopaminérgicas. A través de la secreción de moléculas antioxidantes, estas células pueden contrarrestar la acción de los radicales libres, protegiendo así la integridad celular.
Además, estudios recientes han revelado que las CMMs pueden llevar a cabo un proceso de transferencia mitocondrial, en el cual entregan mitocondrias sanas a las neuronas dañadas. Esta transferencia contribuye a restaurar la función energética celular y a reducir la producción de especies reactivas de oxígeno, disminuyendo así la progresión del daño mitocondrial.
Otro aspecto fundamental es su capacidad para modular la respuesta inmune del sistema nervioso central. Las CMMs pueden disminuir la activación de células microgliales y reducir la liberación de citoquinas proinflamatorias, ayudando a mantener un ambiente más favorable para la regeneración neuronal.
También se ha propuesto que estas células podrían inducir un efecto neurogénico, favoreciendo la diferenciación hacia fenotipos neuronales, incluida la posible generación de nuevas neuronas dopaminérgicas. Aunque esta capacidad aún se encuentra en estudio, refuerza su valor como herramienta terapéutica integral.
En modelos animales de Parkinson, la administración de CMMs ha mostrado mejoras significativas en la función motora, acompañadas de una reducción en la pérdida neuronal. Estos efectos beneficiosos se deben tanto a sus propiedades regenerativas como a su acción sobre procesos patológicos subyacentes, como el estrés oxidativo, la inflamación y el deterioro mitocondrial.
A diferencia de los tratamientos convencionales, que principalmente alivian los síntomas motores, las CMMs ofrecen un enfoque que actúa sobre las causas celulares y moleculares de la enfermedad, lo que las convierte en una alternativa prometedora para modificar su curso progresivo.
Actualmente, varios estudios clínicos están evaluando la seguridad y eficacia del uso de CMMs en pacientes con Parkinson. Si bien los resultados preliminares son alentadores, todavía se requiere más investigación para estandarizar los protocolos de administración, la dosis, la fuente celular y los criterios de selección de pacientes.
A pesar de los desafíos, el potencial terapéutico de las células madre mesenquimales abre una nueva vía para desarrollar tratamientos personalizados, con la capacidad de adaptarse a las necesidades particulares de cada paciente y de intervenir en múltiples mecanismos patológicos al mismo tiempo.
Terapias complementarias: Realidad Virtual en el tratamiento de la Enfermedad de Parkinson
En los últimos años, la realidad virtual (RV) ha emergido como una herramienta innovadora dentro de las terapias complementarias para pacientes con Parkinson. Esta tecnología permite la creación de entornos simulados e interactivos que pueden ser utilizados para fines terapéuticos, particularmente en la rehabilitación motora y cognitiva.
Uno de los principales beneficios de la realidad virtual es que estimula la participación activa del paciente mediante actividades inmersivas que replican situaciones de la vida cotidiana. Esta característica no solo incrementa la motivación, sino que también promueve una mayor adherencia a las terapias, lo cual es fundamental para obtener resultados a largo plazo.
Diversos estudios han demostrado que los programas de rehabilitación en entornos de realidad virtual pueden mejorar significativamente la función motora, en particular el equilibrio, la marcha y la coordinación. Estas mejoras se deben a que los entornos virtuales ofrecen retroalimentación visual, auditiva y sensorial en tiempo real, lo cual estimula la corrección automática de movimientos y la activación de circuitos neuronales implicados en el control motor.
Además de los beneficios físicos, la realidad virtual también ha mostrado efectos positivos en el estado emocional y cognitivo de los pacientes. Al interactuar con escenarios lúdicos y desafiantes, se reduce el estrés y la ansiedad, y se estimula la atención, la memoria y otras funciones ejecutivas. Esta estimulación multisensorial favorece la neuroplasticidad, es decir, la capacidad del cerebro para reorganizarse y adaptarse a nuevas experiencias.
Otro aspecto relevante de la realidad virtual es su potencial para ofrecer tratamientos personalizados. A través de plataformas interactivas, es posible ajustar la dificultad de los ejercicios, adaptar las tareas a las capacidades del paciente y registrar el progreso de manera precisa. Esto permite que cada persona reciba una intervención ajustada a sus necesidades específicas y en constante evolución.
La realidad virtual también se puede integrar en el hogar, lo cual facilita la continuidad del tratamiento más allá del entorno clínico. Esto resulta especialmente útil en etapas avanzadas de la enfermedad o cuando existen barreras para el desplazamiento físico del paciente. Además, el uso de sistemas portátiles y económicos ha contribuido a la accesibilidad de esta tecnología.
En conjunto, los efectos positivos de la realidad virtual sobre la movilidad, el equilibrio, la motivación y la calidad de vida en general, la convierten en una herramienta terapéutica de gran valor dentro del enfoque complementario e integral del tratamiento del Parkinson. Aunque no sustituye los tratamientos farmacológicos, su uso conjunto puede potenciar los beneficios y retrasar el deterioro funcional.
Si bien aún se requiere más investigación para establecer protocolos estandarizados y validar sus efectos a largo plazo, los resultados obtenidos hasta ahora indican que la realidad virtual representa una opción terapéutica prometedora, segura y efectiva, que responde a la necesidad de estrategias innovadoras y centradas en el paciente.
Parkinson vs Alzheimer: ¿Diferencias o similitudes?
Las enfermedades de Parkinson y Alzheimer representan dos de los trastornos neurodegenerativos más comunes, afectando principalmente a personas de edad avanzada. Aunque presentan manifestaciones clínicas distintas, comparten múltiples mecanismos patogénicos, entre ellos el acúmulo de hierro en el cerebro, la disfunción inmunológica y la influencia de factores ambientales como la contaminación del aire.
Mecanismos comunes en la neurodegeneración
Relación con el hierro cerebral
El hierro juega un papel fundamental en el metabolismo neuronal, pero su regulación inadecuada puede contribuir a la neurodegeneración. En ambas enfermedades se ha observado un acúmulo patológico de hierro en regiones específicas del cerebro. En el Alzheimer, este fenómeno se relaciona con la agregación de beta-amiloide y la formación de placas seniles, mientras que en el Enfermedad de Parkinson se asocia con la acumulación de alfa-sinucleína y la degeneración de la sustancia negra.
El exceso de hierro cerebral altera el equilibrio redox, promoviendo la producción de especies reactivas de oxígeno (ROS), que desencadenan estrés oxidativo y daño celular. Asimismo, se ha observado una redistribución del hierro en el cerebro envejecido, donde la acumulación en estructuras profundas contribuye a la progresión de ambas enfermedades. La disfunción mitocondrial inducida por este desbalance redox exacerba la producción de radicales libres, mientras que la peroxidación lipídica daña las membranas neuronales, favoreciendo la muerte celular.
Disfunción inmunológica y neuroinflamación
Otro aspecto clave en la progresión del Alzheimer y la enfermedad de Parkinson es la activación crónica del sistema inmunológico en el cerebro. La microglía, las células inmunitarias residentes del sistema nervioso central, desempeñan un papel dual: pueden proteger a las neuronas eliminando proteínas tóxicas, pero su activación sostenida contribuye a la neuroinflamación y la progresión del daño neuronal.
En el Alzheimer, se ha observado una respuesta inflamatoria exacerbada en torno a los depósitos de beta-amiloide, promovida por la liberación de citocinas proinflamatorias como la interleucina-1 beta (IL-1β) y el factor de necrosis tumoral alfa (TNF-α). En la enfermedad de Parkinson, la activación de la microglía también se asocia con la muerte de neuronas dopaminérgicas y la propagación de agregados de alfa-sinucleína. Este estado inflamatorio persistente no solo acelera la degeneración neuronal, sino que también altera la homeostasis del hierro, creando un círculo vicioso de neuroinflamación y daño oxidativo.
Factores ambientales y progresión acelerada
Contaminación del aire y neurodegeneración temprana
La exposición prolongada a contaminantes ambientales, como partículas en suspensión (PM2.5 y PM10) y óxidos de nitrógeno, ha sido vinculada con un aumento en la incidencia de enfermedades neurodegenerativas. Estudios recientes sugieren que la contaminación del aire puede inducir estrés oxidativo y neuroinflamación, contribuyendo al daño neuronal y acelerando la aparición de síntomas de Alzheimer y enfermedad de Parkinson en edades más tempranas.
Las partículas ultrafinas presentes en el aire contaminado pueden atravesar la barrera hematoencefálica y depositarse en el cerebro, promoviendo la acumulación de hierro en regiones vulnerables. Además, la exposición crónica a estos contaminantes altera la función mitocondrial y favorece la peroxidación lipídica, exacerbando el daño neuronal. Este factor ambiental, combinado con predisposición genética y otros factores de riesgo, podría explicar el aumento en la prevalencia de estas enfermedades en poblaciones urbanas expuestas a altos niveles de contaminación.
Conclusión
El Alzheimer y la enfermedad de Parkinson comparten múltiples mecanismos patogénicos, como el acúmulo anormal de hierro, el desbalance redox, la neuroinflamación y la influencia de factores ambientales. La comprensión de estos procesos es crucial para el desarrollo de estrategias terapéuticas que puedan ralentizar la progresión de ambas enfermedades y mejorar la calidad de vida de los pacientes.

(publicidad)
Referencias:
Kulcsarova K, Skorvanek M, Postuma RB, Berg D. Defining Parkinson's Disease: Past and Future. J Parkinsons Dis. 2024;14(s2):S257-S271
Costa HN, Esteves AR, Empadinhas N, Cardoso SM. Parkinson's Disease: A Multisystem Disorder. Neurosci Bull. 2023 Jan;39(1):113-124. doi: 10.1007/s12264-022-00934-6. Epub 2022 Aug 22. PMID: 35994167; PMCID: PMC9849652.
Carlo Cattaneo, Wolfgang H. Jost. Pain in Parkinson's Disease: Pathophysiology, Classification and Treatment. J. Integr. Neurosci. 2023, 22(5), 132.
Ye H, Robak LA, Yu M, Cykowski M, Shulman JM. Genetics and Pathogenesis of Parkinson's Syndrome. Annu Rev Pathol. 2023 Jan 24;18:95-121.
Horsager J, Borghammer P. Brain-first vs. body-first Parkinson's disease: An update on recent evidence. Parkinsonism Relat Disord. 2024 May;122:106101.
Ben-Shlomo Y, Darweesh S, Llibre-Guerra J, Marras C, San Luciano M, Tanner C. The epidemiology of Parkinson's disease. Lancet. 2024 Jan 20;403(10423):283-292.
Jia F, Fellner A, Kumar KR. Monogenic Parkinson's Disease: Genotype, Phenotype, Pathophysiology, and Genetic Testing. Genes (Basel). 2022 Mar 7;13(3):471.
Trevisan L, Gaudio A, Monfrini E, Avanzino L, Di Fonzo A, Mandich P. Genetics in Parkinson's disease, state-of-the-art and future perspectives. Br Med Bull. 2024 Mar 13;149(1):60-71.
Yousefi P, Ghadirian S, Mobedi M, Jafarzadeh M, Alirezaei A, Gholami A, Tabibzadeh A. Autophagy related genes polymorphisms in Parkinson's Disease; A systematic review of literature. Clin Park Relat Disord. 2025 Feb 24;12:100312.
Ciampelli C, Galleri G, Galioto M, Mereu P, Pirastru M, Bernardoni R, Albani D, Crosio C, Iaccarino C. LRRK2 in Drosophila Melanogaster Model: Insights into Cellular Dysfunction and Neuroinflammation in Parkinson's Disease. Int J Mol Sci. 2025 Feb 27;26(5):2093.
Calderón-Garcidueñas L, González-Maciel A, Reynoso-Robles R, Cejudo-Ruiz FR, Silva-Pereyra HG, Gorzalski A, Torres-Jardón R. Alzheimer's, Parkinson's, Frontotemporal Lobar Degeneration, and Amyotrophic Lateral Sclerosis Start in Pediatric Ages: Ultrafine Particulate Matter and Industrial Nanoparticles Are Key in the Early-Onset Neurodegeneration: Time to Invest in Preventive Medicine. Toxics. 2025 Feb 28;13(3):178.
Bae M, Kim N, Cho E, Lee T, Lee JH. Recent Advances in Electrochemical Biosensors for Neurodegenerative Disease Biomarkers. Biosensors (Basel). 2025 Feb 28;15(3):151.
Rosal AE, Martin SL, Strafella AP. The role of Apolipoprotein E4 on cognitive impairment in Parkinson's disease and Parkinsonisms. Front Neurosci. 2025 Feb 20;19:1515374.
Gao Q, Zhou Y, Chen Y, Hu W, Jin W, Zhou C, Yuan H, Li J, Lin Z, Lin W. Role of iron in brain development, aging, and neurodegenerative diseases. Ann Med. 2025 Dec;57(1):2472871.
Tong S, Wang R, Li H, Tong Z, Geng D, Zhang X, Ren C. Executive dysfunction in Parkinson's disease: From neurochemistry to circuits, genetics and neuroimaging. Prog Neuropsychopharmacol Biol Psychiatry. 2025 Mar 20;137:111272.
Huang Y, Zhang G, Li S, Feng J, Zhang Z. Innate and adaptive immunity in neurodegenerative disease. Cell Mol Life Sci. 2025 Feb 2;82(1):68.
Serag I, Azzam AY, Hassan AK, Diab RA, Diab M, Hefnawy MT, Ali MA, Negida A. Multimodal diagnostic tools and advanced data models for detection of prodromal Parkinson's disease: a scoping review. BMC Med Imaging. 2025 Mar 28;25(1):103.
Zeng W, Liang X, Guo J, Cheng W, Yin Z, Hong D, Li F, Zhou F, Fang X. Hippocampal functional imaging-derived radiomics features for diagnosing cognitively impaired patients with Parkinson's disease. BMC Neurosci. 2025 Mar 28;26(1):27.
Bera S, Geem ZW, Cho YI, Singh PK. A Comparative Study of Machine Learning and Deep Learning Models for Automatic Parkinson's Disease Detection from Electroencephalogram Signals. Diagnostics (Basel). 2025 Mar 19;15(6):773.
Kõks S. The Exon-Based Transcriptomic Analysis of Parkinson's Disease. Biomolecules. 2025 Mar 19;15(3):440.
Elsworth JD. Parkinson's disease treatment: past, present, and future. J Neural Transm (Vienna). 2020 May;127(5):785-791.
Weintraub D, Aarsland D, Chaudhuri KR, Dobkin RD, Leentjens AF, Rodriguez-Violante M, Schrag A. The neuropsychiatry of Parkinson's disease: advances and challenges. Lancet Neurol. 2022 Jan;21(1):89-102.
Church FC. Treatment Options for Motor and Non-Motor Symptoms of Parkinson's Disease. Biomolecules. 2021 Apr 20;11(4):612.
Buck AC, Maarman GJ, Dube A, Bardien S. Mitochondria targeted nanoparticles for the treatment of mitochondrial dysfunction-associated brain disorders. Front Bioeng Biotechnol. 2025 Mar 12;13:1563701.
Caproni S, Di Fonzo A, Colosimo C. Oxidative Stress: A New Pathophysiological Pathway in Parkinson's Disease and a Potential Target of the Brain-Sport Crosstalk. Parkinsons Dis. 2025 Mar 21;2025:6691390.
De Natale G, Qorri E, Todri J, Lena O. Impact of Virtual Reality Alone and in Combination with Conventional Therapy on Balance in Parkinson's Disease: A Systematic Review with a Meta-Analysis of Randomized Controlled Trials. Medicina (Kaunas). 2025 Mar 17;61(3):524.