Entendiendo el Cáncer de Próstata: De la Biología del Tumor a las Últimas Opciones de Tratamiento
José Hernández Jiménez
6/2/202539 min leer



El cáncer de próstata es uno de los tipos de cáncer más comunes en el mundo y representa una causa importante de muerte relacionada con enfermedades oncológicas en los hombres. Comprender su epidemiología y factores de riesgo es esencial para desarrollar estrategias de prevención efectivas. Existen factores de riesgo no modificables bien establecidos, como la edad, la raza, los antecedentes familiares y ciertas mutaciones genéticas heredadas. También se han identificado factores de riesgo modificables, entre ellos el síndrome metabólico, la obesidad y el tabaquismo. Otros elementos relacionados con el entorno, el estilo de vida, las infecciones y la alimentación podrían influir en el desarrollo del cáncer de próstata, aunque la evidencia en estos casos aún es limitada.
Este tipo de cáncer se origina con mayor frecuencia en la zona periférica de la próstata, donde puede iniciar con alteraciones celulares conocidas como neoplasia intraepitelial prostática, que pueden progresar hacia un cáncer localizado y, en etapas más avanzadas, convertirse en adenocarcinoma prostático y diseminarse a otras partes del cuerpo. La inflamación crónica puede contribuir al desarrollo de tumores malignos a partir de células de la próstata. Los tratamientos disponibles para el cáncer de próstata localizado incluyen la prostatectomía radical, la radioterapia y la terapia hormonal, y presentan una alta tasa de supervivencia a cinco años. Sin embargo, en muchos casos el cáncer evoluciona a una etapa resistente a la castración, conocida como cáncer de próstata resistente a la terapia de privación de andrógenos, en la que ya se ha producido metástasis y hay pocas opciones de tratamiento eficaces. Por ello, es urgente desarrollar nuevas estrategias terapéuticas que permitan controlar la enfermedad a largo plazo y mejorar la supervivencia de los pacientes.
Epidemiologia
Incidencia de cáncer de próstata
El cáncer de próstata es una de las enfermedades oncológicas más comunes en hombres a nivel mundial. La Organización Mundial de la Salud (OMS) estimó que en 2020 esta enfermedad fue responsable de aproximadamente 10 millones de muertes, lo que representa casi una de cada seis defunciones por cáncer en ese año. A nivel global, se registraron más de 1.4 millones de casos nuevos de cáncer de próstata y aproximadamente 375,000 muertes atribuidas a esta causa. En términos de frecuencia, este tipo de cáncer ocupa el tercer lugar en incidencia y el segundo lugar entre los cánceres que afectan exclusivamente a los hombres.
El cáncer de próstata presenta tasas de incidencia relativamente similares entre distintas regiones del mundo, aunque existen variaciones importantes. Por ejemplo, en América Latina se ubica como el cáncer más común en hombres, mientras que en Asia ocupa el octavo lugar. Estas diferencias sugieren que factores raciales, étnicos, socioeconómicos, y biológicos influyen en el desarrollo de la enfermedad, incluyendo una posible predisposición genética a formas más agresivas del cáncer.
Los estudios muestran que los hombres de ascendencia africana tienen una mayor incidencia y peor pronóstico frente al cáncer de próstata, incluso cuando se compara a poblaciones con acceso similar a servicios de salud. Hombres afroamericanos, del Caribe, y de Europa negra presentan mayores tasas de incidencia que los hombres blancos, y sus tasas de mortalidad son aproximadamente el doble, lo que indica un componente genético significativo en el desarrollo del cáncer de próstata.
Análisis realizados en biopsias de pacientes de África subsahariana han revelado una proporción considerable de tumores de alto grado (puntuación de Gleason igual o mayor a 8). Sin embargo, las limitaciones en el acceso a la salud y las inconsistencias en los registros de cáncer en algunos países complican la interpretación precisa de los datos epidemiológicos respecto a la relación entre raza, etnicidad, geografía y agresividad del cáncer.
La edad es otro factor determinante en la aparición del cáncer de próstata. La edad promedio al momento del diagnóstico primario es de 67 años, y la incidencia es especialmente alta en el grupo de 75 a 79 años. En 2022, las tasas de incidencia por cada 100,000 personas fueron de 155 casos en hombres de 55 a 59 años, 510 casos en los de 65 a 69 años, y 751 casos en los de 75 a 79 años.
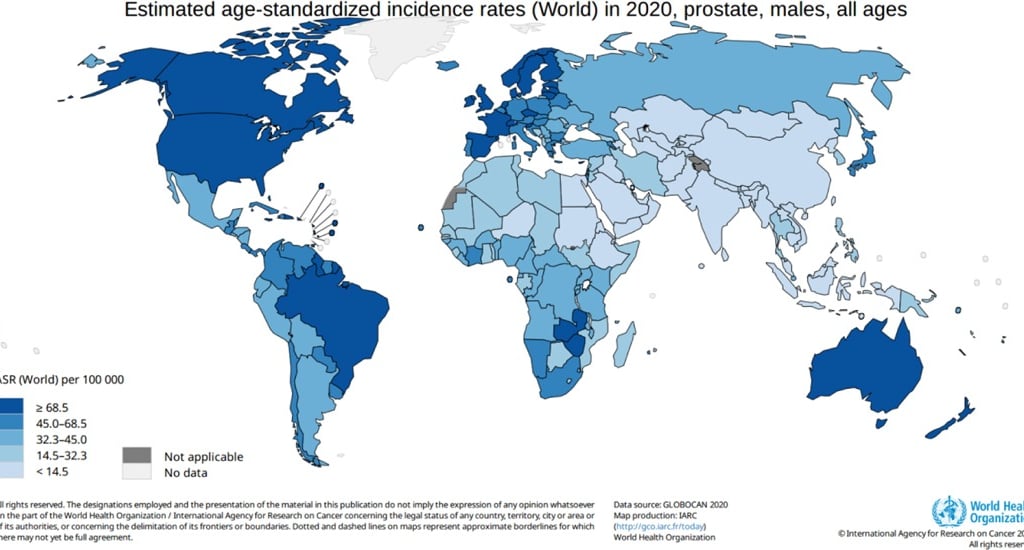
Imagen: Bergengren O, Pekala KR, Matsoukas K, Fainberg J, Mungovan SF, Bratt O, Bray F, Brawley O, Luckenbaugh AN, Mucci L, Morgan TM, Carlsson SV. 2022 Update on Prostate Cancer Epidemiology and Risk Factors-A Systematic Review. Eur Urol. 2023 Aug;84(2):191-206
Mortalidad
La mortalidad asociada al cáncer de próstata varía significativamente dependiendo del estadio en el que se detecta la enfermedad. Cuando se diagnostica en etapas tempranas y localizadas, los pacientes tienen una expectativa de vida de hasta 99% a 10 años, dependiendo de su edad, comorbilidades y tratamiento. Sin embargo, aproximadamente el 5% de los hombres desarrollan metástasis a distancia, y la tasa de supervivencia a cinco años en estos casos es de solo 30%.
Casi todos los pacientes con cáncer de próstata metastásico progresan eventualmente hacia una forma de la enfermedad resistente a la castración, es decir, resistente a las terapias de supresión hormonal. Esta progresión representa una de las principales causas de morbilidad y mortalidad en esta enfermedad.
A pesar del conocimiento creciente sobre el papel del sistema inmunológico en la prevención y control del cáncer, hay una falta de estudios epidemiológicos que analicen la relación entre el estado inmune, la inflamación subclínica (de origen infeccioso o endógeno), y la aparición del cáncer de próstata. Este es un campo emergente de interés, ya que se sospecha que la activación sostenida del sistema inmune innato podría favorecer el desarrollo tumoral.
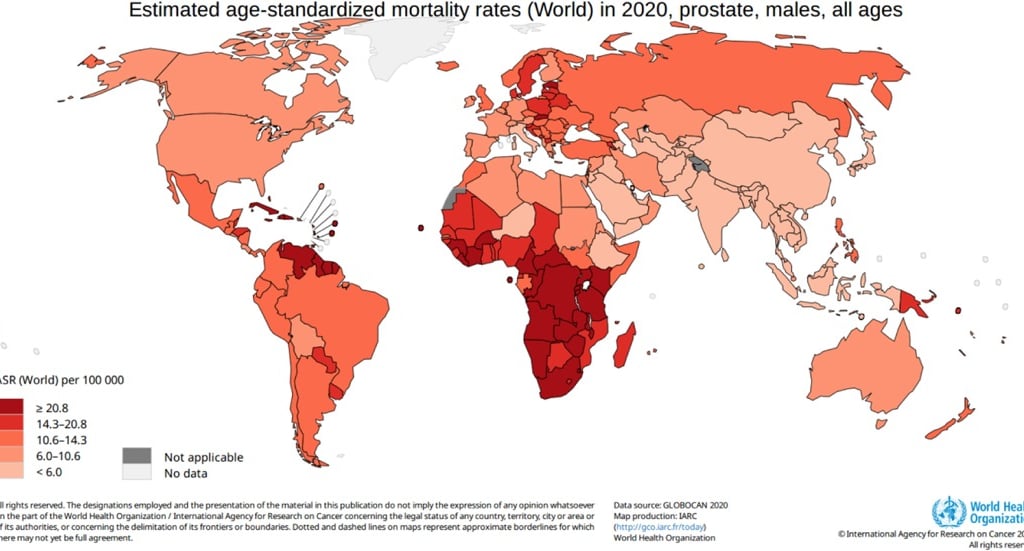
Imagen: Bergengren O, Pekala KR, Matsoukas K, Fainberg J, Mungovan SF, Bratt O, Bray F, Brawley O, Luckenbaugh AN, Mucci L, Morgan TM, Carlsson SV. 2022 Update on Prostate Cancer Epidemiology and Risk Factors-A Systematic Review. Eur Urol. 2023 Aug;84(2):191-206
Distribución geográfica
El cáncer de próstata es el cáncer más diagnosticado en hombres en más de la mitad de los países del mundo, con una mayor incidencia en Europa Occidental y del Norte, el Caribe, Australia/Nueva Zelanda, América del Norte y del Sur, y el sur de África. En contraste, las tasas de mortalidad más altas se registran en el Caribe, partes de Sudamérica, y el África subsahariana. Estas diferencias reflejan desigualdades en los sistemas de salud, acceso a diagnóstico, tratamiento, y la infraestructura médica disponible.
Llamativamente, existe una relación inversa entre la incidencia y la mortalidad por cáncer de próstata entre continentes. En América del Norte, por ejemplo, las tasas de incidencia son altas, pero la mortalidad es baja, lo que sugiere una detección temprana eficaz y tratamientos accesibles. En cambio, en África, aunque la incidencia reportada es más baja, las tasas de mortalidad son las más elevadas, lo que apunta a deficiencias importantes en el acceso a servicios médicos.
En países como Sudáfrica, se observa una tasa elevada tanto de incidencia como de mortalidad por cáncer de próstata, lo que indica que, aunque el diagnóstico es relativamente eficaz, las opciones terapéuticas no alcanzan los estándares necesarios para reducir la mortalidad. En comparación con otros tipos de cáncer, el cáncer de próstata destaca en este país por su alta letalidad, lo que resalta la necesidad urgente de mejorar el acceso y la calidad del tratamiento.
En los Estados Unidos, los hombres afroamericanos tienen una probabilidad 1.7 veces mayor de ser diagnosticados con cáncer de próstata y 2.1 veces mayor de morir por esta enfermedad en comparación con los hombres blancos. Esta disparidad no se puede atribuir completamente al concepto de raza, considerado un constructo sociopolítico, sino más bien a factores relacionados con la ascendencia genética, el entorno y las condiciones sociales.
(publicidad)
Inflamación y Patogénesis del Cáncer de Próstata: Una Relación Silenciosa que Alimenta el Tumor
El cáncer de próstata es una enfermedad que surge por una serie de cambios genéticos acumulados que favorecen la multiplicación de las células prostáticas, evitando su muerte natural. Detectar estos cambios en etapas tempranas permite prevenir la progresión del tumor hacia formas más agresivas, mejorar el pronóstico y aumentar las posibilidades de tratamiento exitoso. Diversos estudios han sugerido que la prostatitis sintomática, especialmente en su forma aguda, podría estar relacionada con un mayor riesgo de desarrollar cáncer de próstata. La inflamación persistente de la glándula prostática podría contribuir al desarrollo tumoral al causar daño celular y alterar mecanismos de control del crecimiento celular.
Uno de los factores clave en esta relación es la inflamación crónica, que puede provocar daño en el ADN y activar rutas de señalización que favorecen mutaciones. Además, este tipo de inflamación libera citocinas y factores de crecimiento que estimulan la formación de vasos sanguíneos (angiogénesis), la proliferación celular y la remodelación del tejido prostático. El reclutamiento continuo de células inmunitarias como macrófagos y linfocitos T al tejido inflamado puede crear un entorno que facilita el crecimiento del tumor y su capacidad para evadir el sistema inmune. Una vía importante involucrada es la de fosfatidilinositol 3-cinasa (PI3K), cuya activación excesiva, especialmente cuando hay pérdida de la proteína reguladora PTEN, favorece la proliferación celular y el avance del cáncer.
En sus etapas iniciales, el cáncer de próstata generalmente se localiza en la zona periférica de la glándula y puede ser multifocal. Si no se trata a tiempo, puede invadir estructuras cercanas como las vesículas seminales o extenderse a través del torrente sanguíneo a órganos distantes como los huesos y los pulmones. Para determinar la gravedad y planificar el tratamiento, se utilizan herramientas como la clasificación TNM, los niveles de antígeno prostático específico (PSA) y el análisis del grado de agresividad del tumor en el microscopio. Estos factores ayudan a personalizar el tratamiento y a identificar a los pacientes que necesitan estudios adicionales o terapias más intensivas.
La inflamación también se manifiesta en el tejido tumoral con infiltrados de células inmunitarias, lo que puede originar lesiones precursoras como la atrofia inflamatoria proliferativa. En este contexto, se investigan biomarcadores inmunológicos presentes en células como los monocitos, que podrían ayudar a predecir la respuesta al tratamiento y guiar terapias personalizadas. Las quimiocinas, proteínas que dirigen el movimiento de las células del sistema inmune, juegan un papel importante en la evolución del cáncer, ya que atraen a células que promueven la inflamación y el crecimiento tumoral. Varias de estas moléculas, como CCL2, CXCL8 y CXCR4, se encuentran elevadas en el cáncer de próstata y pueden ser moduladas por hormonas y compuestos naturales con propiedades antitumorales.
Como se ha mencionado anteriormente, un aspecto preocupante es la capacidad del cáncer de próstata para formar metástasis óseas, una complicación grave en la evolución de la enfermedad. La grasa acumulada en la médula ósea puede aumentar la producción de quimiocinas que favorecen el crecimiento tumoral en ese entorno. Además, algunos receptores celulares, como CXCR2, se han identificado como blancos prometedores para nuevos tratamientos. Fármacos como el cabozantinib, que inhiben ciertas vías de señalización, han mostrado eficacia en reducir el tumor al modificar el entorno inmunológico. Otros genes, como RUNX2 y GNA13, también participan en la regulación de estas vías, y su inhibición ha permitido frenar la progresión del cáncer en estudios experimentales. Por tanto, comprender la interacción entre inflamación, señales moleculares y sistema inmunológico resulta clave para desarrollar estrategias terapéuticas más efectivas contra el cáncer de próstata.
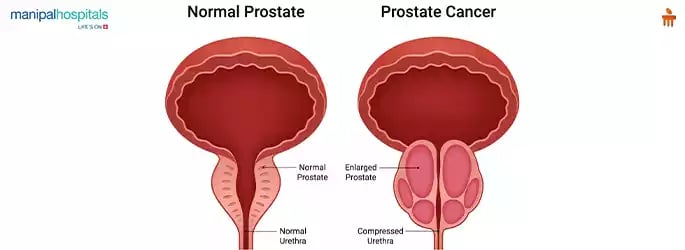
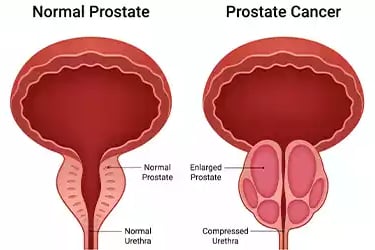
Revolucionando el Diagnóstico del Cáncer de Próstata: ¿Son los Biomarcadores el Futuro?
El diagnóstico del cáncer de próstata se realiza mediante el procedimiento estándar de biopsia por aguja guiada por ecografía transrectal, el cual se indica cuando existen factores como un antígeno prostático específico (PSA) elevado, cambios en los niveles de PSA a lo largo del tiempo, un examen digital rectal (DRE) anormal, antecedentes familiares, raza o una biopsia previa con resultados anormales. No obstante, el uso del PSA como herramienta de detección ha sido criticado debido a que puede conducir al sobrediagnóstico y sobretratamiento, ya que una gran proporción de los casos detectados son de bajo o riesgo intermedio. Para reducir biopsias innecesarias y mejorar la precisión diagnóstica, se ha validado el uso de la resonancia magnética multiparamétrica (mpMRI) como herramienta de cribado. Por ello, la identificación de biomarcadores que permitan reconocer casos clínicamente significativos se ha vuelto prioritaria. Un biomarcador ideal debe tener alta sensibilidad y especificidad, ser reproducible, de uso sencillo, con resultados cuantificables y aplicables a diferentes grupos raciales, además de ser económicamente accesible. Sin embargo, existen pocas comparaciones entre biomarcadores disponibles y, en muchos estudios, los participantes son mayoritariamente hombres de origen caucásico, con escasa representación de hombres afroamericanos, a pesar de que estos últimos presentan tasas más altas de incidencia y mortalidad por cáncer de próstata. Esto resalta la necesidad de evaluar la utilidad clínica de los biomarcadores disponibles considerando las diferencias raciales.
Biomarcadores en el Microambiente Tumoral: Nuevas Ventanas para el Diagnóstico del Cáncer de Próstata
El cáncer de próstata es una enfermedad compleja en la que la mayoría de los casos son de tipo esporádico, sin un origen hereditario claro. Este tipo de cáncer se desarrolla principalmente debido a la inactivación de genes supresores de tumores y la activación de oncogenes, que promueven el crecimiento descontrolado de las células. Aunque solo una minoría de casos tiene antecedentes familiares, estas mutaciones hereditarias pueden aumentar significativamente el riesgo de padecer la enfermedad. Se han identificado varios genes implicados en la reparación del ADN y en la regulación del ciclo celular, como BRCA1, BRCA2, ATM, y PALB2, cuya alteración está asociada a formas más agresivas del cáncer. Además, alteraciones genómicas específicas, como la fusión anormal de genes que regulan la respuesta hormonal, contribuyen a la progresión y a la heterogeneidad del tumor.
El avance en las técnicas de secuenciación genética ha permitido detectar múltiples mutaciones y variantes genéticas asociadas con el riesgo y la agresividad del cáncer de próstata. Estudios amplios del genoma han identificado regiones específicas que contienen pequeñas variantes genéticas, conocidas como polimorfismos de nucleótido único, que afectan la predisposición y el comportamiento de la enfermedad, mostrando diferencias según el origen étnico de los pacientes. Estas variantes influyen en la estabilidad genética y en rutas celulares clave para la progresión tumoral, lo que subraya la importancia de considerar la diversidad genética en el desarrollo de estrategias diagnósticas y terapéuticas personalizadas.
Además de las alteraciones genéticas, los cambios epigenéticos como la metilación del ADN y las modificaciones en las histonas juegan un papel fundamental en la regulación de la expresión génica en el cáncer de próstata. Estas modificaciones pueden silenciar genes supresores de tumores y afectar la estructura de la cromatina, contribuyendo a la progresión tumoral y a la resistencia a tratamientos. Los microARNs, pequeñas moléculas reguladoras del ARN mensajero, también emergen como biomarcadores prometedores, ya que reflejan el estado biológico del tumor y pueden detectarse en fluidos corporales de manera no invasiva. En conjunto, la integración de biomarcadores genéticos, epigenéticos y moleculares ofrece un enfoque innovador para mejorar la detección temprana, el pronóstico y la personalización del tratamiento en pacientes con cáncer de próstata.
En este artículo veremos tres categorías de biomarcadores en función de la procedencia de la muestra:
Biomarcadores de muestras de orina
El cáncer de próstata es una enfermedad heterogénea, y su detección temprana continúa siendo un desafío clínico importante. Una de las alteraciones genéticas más comunes asociadas a esta patología es la formación del oncogén de fusión TMPRSS2-ERG, resultado de la unión anómala de dos genes. Esta fusión solo se presenta en tejidos cancerosos de la próstata y no en tejido sano ni en casos de hiperplasia benigna, lo que lo convierte en un marcador genético específico y precoz. Su detección en orina tras un masaje prostático ha demostrado ser útil tanto para el diagnóstico como para evaluar la progresión de la enfermedad.
El cáncer de próstata que expresa el gen ERG suele presentar un patrón distintivo de hipermetilación, un cambio epigenético que silencia genes relevantes para la regulación celular. Además, se ha observado que otras fusiones entre TMPRSS2 y genes de la familia ETS activan vías moleculares implicadas en el desarrollo tumoral, como las rutas de señalización Wnt y Notch, las cuales son influenciadas por la actividad de los receptores de andrógenos.
En contraste, el cáncer de próstata que no presenta la fusión ERG suele mostrar una biología diferente. Este subtipo se asocia con mutaciones en genes como SPOP, FOXA1 y con la pérdida del gen CHD1, características que podrían relacionarse con formas más agresivas de la enfermedad. En estos casos, los biomarcadores tradicionales como el antígeno prostático específico y la escala de Gleason resultan ser herramientas diagnósticas más precisas.
La metilación del ADN también puede ser analizada en orina, ofreciendo una alternativa menos invasiva a la biopsia. En un estudio clínico con más de 500 muestras de orina recolectadas antes del tratamiento, se investigaron los genes RARB, RASSF1 y GSTP1, observándose que más del 80% de los pacientes con cáncer de próstata confirmado presentaban alteraciones de metilación en al menos uno de estos genes. Estos resultados destacan el potencial de los perfiles de metilación como marcadores sensibles y específicos para la detección precoz.
La búsqueda de biomarcadores no invasivos ha impulsado el análisis de microARNs (miARNs) en orina. Estas pequeñas moléculas reguladoras pueden encontrarse en exosomas, vesículas extracelulares presentes en los fluidos corporales. Algunos miARNs como miR-298, miR-346 y miR-141 han demostrado utilidad para diferenciar entre enfermedad localizada y metastásica. Además, el cociente entre miR-125a-5p y miR-141-5p ha sido propuesto como un marcador más preciso que el análisis individual de cada uno. Un modelo diagnóstico que combina tres microARNs —miR-222-3p, miR-24-3p y miR-30c-5p— ha mostrado ser efectivo para diferenciar entre hiperplasia prostática benigna y cáncer de próstata.
Uno de los biomarcadores más estudiados es el Prostate Cancer Antigen 3 (PCA3), un ARN mensajero no codificante específico de la próstata, sobreexpresado en más del 90% de los tumores. Su detección se realiza en orina tras un examen rectal digital. La prueba comercial Progensa PCA3, aprobada por la agencia reguladora de medicamentos en Estados Unidos, se emplea en hombres con niveles elevados de antígeno prostático específico y biopsias previas negativas. Su puntuación refleja la proporción de ARN PCA3 respecto al PSA, ayudando a predecir la presencia de cáncer con una sensibilidad y especificidad variables según el punto de corte seleccionado.
Otra herramienta es el test SelectMDx, que evalúa los niveles de ARN de los genes HOXC6 y DLX1, ambos asociados al cáncer de próstata agresivo. Esta prueba se complementa con el análisis de factores clínicos como edad, densidad del PSA y hallazgos del examen físico. Los estudios han reportado una sensibilidad y valor predictivo negativo superiores al 90%, y cuando se combina con otras variables clínicas, su capacidad diagnóstica alcanza un área bajo la curva (AUC) de hasta 0.9.
El test ExoDx Prostate (IntelliScore) utiliza ARN contenido en exosomas urinarios para medir la expresión de los genes PCA3, ERG y un gen de control (SPDEF), sin necesidad de masaje prostático. Este análisis ha demostrado una alta sensibilidad (92%) y un valor predictivo negativo del 91%. En pacientes con biopsias previas, ha reducido significativamente las biopsias innecesarias, sin comprometer la detección de cánceres de alto grado.
Un panel combinado que incluye los genes PCA3 y PCGEM1 también ha sido desarrollado. Este último es un ARN no codificante expresado preferentemente en hombres afroamericanos con cáncer de próstata. Al combinarse con factores clínicos, este panel mejora la detección de cáncer de grado 2 o superior, con una capacidad diagnóstica superior al uso exclusivo de factores clínicos.
Por último, la prueba MiPS (Mi-Prostate Score) combina tres componentes: la fusión genética TMPRSS2-ERG, el PCA3 y el nivel de PSA en sangre. Este test, realizado tras el examen rectal digital, ha mostrado mejor desempeño que el PSA aislado, con una AUC de 0.77. En estudios multicéntricos, redujo biopsias innecesarias en un 33%, con una tasa de omisión de cánceres de alto grado de solo el 3%.
En conjunto, estos enfoques basados en biomarcadores urinarios ofrecen herramientas prometedoras para el diagnóstico temprano, la evaluación de la agresividad del cáncer de próstata y la reducción del número de biopsias. Al integrar marcadores moleculares con factores clínicos, se mejora notablemente la precisión diagnóstica, acercando la práctica médica hacia una detección más personalizada y menos invasiva de esta enfermedad.
Biomarcadores sanguíneos
El cáncer de próstata es una enfermedad que en la mayoría de los casos ocurre de forma esporádica, aunque entre el cinco y el diez por ciento tiene un componente hereditario. Este riesgo hereditario es más notable cuando existen antecedentes familiares de primer grado. Las mutaciones en genes como BRCA1 y BRCA2 aumentan significativamente el riesgo y la agresividad del cáncer. Otras mutaciones en genes relacionados con la reparación del ADN, como ATM, CHEK2, PALB2, RAD51D, entre otros, dificultan la capacidad del cuerpo para corregir el daño genético, favoreciendo así la aparición de la enfermedad.
Actualmente, las tecnologías de secuenciación avanzada permiten analizar múltiples genes simultáneamente para detectar mutaciones poco frecuentes que pueden elevar el riesgo de cáncer de próstata hasta un sesenta por ciento. Además, estudios genéticos han identificado cientos de variantes conocidas como polimorfismos de un solo nucleótido que se asocian con un mayor riesgo, aunque muchas de estas variantes aún no han sido validadas en diferentes poblaciones, dado que la mayoría de las investigaciones se han centrado en hombres de ascendencia europea.
Las variantes específicas en genes como ATM, CDKN1B y ESR2 también han sido vinculadas a un mayor riesgo y a formas más agresivas de cáncer de próstata. Por ejemplo, el gen ATM regula proteínas importantes para la respuesta al daño en el ADN, como TP53 y BRCA1. Asimismo, variantes en la región cromosómica 8q24, cercana al oncogén MYC, están relacionadas con diferentes tipos de cáncer, incluyendo el de próstata, ya que pueden influir en la expresión de genes implicados en vías de señalización celular que promueven el desarrollo tumoral.
Entre este tipo de biomarcadores, la metilación del ADN libre circulante se ha convertido en una herramienta prometedora. Los patrones de metilación, que representan modificaciones químicas en el ADN, permiten diferenciar entre cáncer localizado y metastásico con alta precisión. Los tumores metastásicos muestran una hipermetilación extendida en ciertas regiones y una hipometilación en otras, reflejando el avance de la enfermedad. También se han identificado cambios en la metilación de células T circulantes, relacionados con la gravedad del cáncer y la vigilancia inmune, lo que sugiere una conexión entre la regulación epigenética y la progresión tumoral.
Otro tipo importante de biomarcadores son los microARNs circulantes, pequeñas moléculas de ARN que regulan la expresión génica. Uno de los más estudiados es miR-21, que se encuentra elevado en pacientes con cáncer de próstata avanzado. Este microARN promueve la invasión tumoral, la resistencia a tratamientos y la supervivencia celular al inhibir genes supresores de tumores. Su detección en sangre presenta alta sensibilidad y especificidad para distinguir entre enfermedad benigna, cáncer localizado y cáncer resistente a la terapia hormonal.
Otros microARNs relevantes son miR-141, miR-375, miR-298 y miR-346, los cuales también se encuentran en niveles elevados en pacientes con cáncer de próstata en comparación con personas sanas. En particular, miR-141 ha demostrado ser útil para diferenciar entre cáncer localizado y metastásico, mostrando un mejor rendimiento diagnóstico que el marcador tradicional utilizado en sangre. Además, combinaciones de microARNs, como miR-15b-5p y miR-106b-5p, se han asociado con la agresividad de la enfermedad y mejoran la precisión diagnóstica cuando se usan junto con otros marcadores.
Entre las pruebas basadas en proteínas y biomarcadores combinados, la prueba conocida como 4Kscore ha demostrado mejorar la detección de cáncer de próstata clínicamente significativo. Esta prueba mide cuatro proteínas relacionadas con la enfermedad y, junto con factores clínicos como la edad y los resultados del examen físico, calcula la probabilidad de encontrar un cáncer agresivo en una biopsia futura. Estudios han mostrado que el uso de esta prueba puede reducir biopsias innecesarias sin retrasar el diagnóstico de cánceres relevantes, incluso en poblaciones diversas.
Otra prueba importante es el Índice de Salud Prostática, que combina varios tipos de proteínas relacionadas con el antígeno prostático para estimar el riesgo de cáncer significativo. Esta herramienta es especialmente útil en hombres con niveles dudosos de antígeno prostático y ha mostrado mejor rendimiento que los análisis individuales de proteínas. Además, su combinación con otras técnicas, como la resonancia magnética, mejora aún más la capacidad de identificar cáncer agresivo y evitar biopsias innecesarias.
Por último, las células tumorales circulantes en sangre son otro biomarcador prometedor, especialmente para el pronóstico y detección temprana del cáncer de próstata. Estas células cancerosas liberadas al torrente sanguíneo pueden identificarse mediante métodos citológicos e inmunológicos, mostrando alta precisión diagnóstica. La detección de enzimas específicas en estas células también mejora la identificación de pacientes con niveles dudosos de antígeno prostático. Sin embargo, es necesario continuar con estudios que evalúen su utilidad en diversas poblaciones y que definan cómo integrar estos biomarcadores en la práctica clínica para un diagnóstico temprano y preciso del cáncer de próstata.
Biomarcadores obtenidos por biopsia
Las células tumorales del cáncer de próstata presentan una notable inestabilidad genética, caracterizada por la ganancia o pérdida de segmentos completos de cromosomas. Entre las alteraciones más comunes se encuentran la ganancia de regiones en los cromosomas 7 y 8q, así como la pérdida en 8p, 13q, 16q y 18. Conforme el cáncer progresa, se incrementan las reordenaciones estructurales del ADN, tales como translocaciones y deleciones, que contribuyen a la evolución tumoral.
Diversos estudios han identificado mutaciones en genes clave relacionados con el desarrollo y avance del cáncer de próstata. Entre ellos destacan SPOP, FOXA1, IDH1, TP53, PTEN, PIK3CA, BRAF, CTNNB1, HRAS, AKT1 y BRCA2. En las formas avanzadas, especialmente en el cáncer de próstata resistente a la castración, se detectan mutaciones adicionales en genes como AR, MYC, PTEN y ZMYM3, que están vinculadas a la resistencia a los tratamientos hormonales.
El análisis genético de biopsias ha permitido identificar variantes asociadas a formas más agresivas de esta enfermedad. Algunas de estas variantes afectan genes como DAB2IP, TNRC6B y HS3ST3A1, así como regiones intergénicas de los cromosomas 10q26, 15q21 y 19q13. Estas mutaciones se correlacionan con tumores de alto grado de malignidad, niveles elevados del antígeno prostático específico y resistencia al tratamiento hormonal.
Una variante genética particularmente estudiada es rs11672691, localizada en una región intergénica, que se asocia con la progresión del cáncer, la aparición de resistencia a la castración y una mayor mortalidad. Esta variante parece regular la expresión de genes como PCT19 y CEACAM21, implicados en el crecimiento, invasión y metástasis tumoral. El análisis combinado de estas variantes y la expresión génica puede ser útil para predecir la recurrencia y supervivencia del paciente.
La metilación del ADN es una modificación epigenética estable y precoz que ocurre en el genoma de los pacientes con cáncer de próstata, incluso antes de que aparezcan síntomas. Normalmente, las regiones conocidas como islas CpG no están metiladas en células normales. Sin embargo, una metilación aberrante en estas regiones, especialmente en genes supresores de tumores, puede inactivar su función y favorecer el desarrollo y progresión del cáncer.
Se han identificado numerosos genes metilados relacionados con el cáncer de próstata, involucrados en procesos esenciales como la reparación del ADN, el control del ciclo celular, la apoptosis, la adhesión celular y la señalización. La metilación del ADN es mucho más frecuente que las mutaciones genéticas en esta enfermedad, por lo que representa una herramienta valiosa para el diagnóstico en tejidos frescos y almacenados.
Un estudio en tejido prostático mostró que los niveles de metilación del ADN permiten diferenciar con alta precisión entre cáncer de próstata y condiciones benignas, superando incluso la capacidad predictiva del antígeno prostático específico. En las etapas tempranas del cáncer, los cambios en metilación son globales, mientras que en formas agresivas son más localizados, con hipermetilación consistente en islas CpG y una mayor variabilidad en hipometilación.
El análisis masivo de muestras ha identificado biomarcadores específicos para el cáncer de próstata, que permiten diferenciar tejidos normales, benignos y cancerosos. Además, estos biomarcadores pueden distinguir el cáncer de próstata de otros tumores del sistema urinario, como los de vejiga y riñón, facilitando así diagnósticos más precisos.
El gen CD24 es un ejemplo importante, pues su promotor muestra niveles elevados de metilación en muestras cancerosas, lo que se asocia con mayor expresión del gen y un pronóstico desfavorable. En otros cánceres, como mama y ovario, CD24 también está vinculado a mecanismos de evasión del sistema inmunológico, sugiriendo un papel similar en el cáncer de próstata.
La metilación también es útil para detectar formas poco comunes de cáncer de próstata, como el tipo neuroendocrino. En un grupo de pacientes, este análisis logró identificar este subtipo con alta sensibilidad y especificidad, información clave para orientar las decisiones terapéuticas.
Desde el punto de vista pronóstico, ciertos patrones de metilación se asocian con un mayor riesgo de recaída bioquímica y mortalidad específica por cáncer de próstata. Se han desarrollado paneles pronósticos basados en genes con hipermetilación significativa, que han sido validados en distintos grupos de pacientes y ofrecen herramientas para personalizar el tratamiento.
Una prueba comercial, ConfirmMDx, analiza la metilación de genes específicos como GSTP1, APC y RASSF1 en muestras de biopsia prostática. Esta prueba se utiliza para confirmar diagnósticos cuando la biopsia inicial resulta negativa, ya que detecta el llamado "efecto de campo", sugiriendo la presencia de cáncer oculto en la próstata.
ConfirmMDx ha demostrado un valor predictivo negativo alto, lo que significa que un resultado negativo indica con gran certeza la ausencia de cáncer. Estudios han mostrado que esta prueba es un predictor independiente para identificar pacientes que sí tienen cáncer en biopsias posteriores, mejorando la toma de decisiones clínicas.
Los estudios también han validado la utilidad de ConfirmMDx en distintas poblaciones, incluyendo hombres afroamericanos, mostrando resultados comparables a los observados en poblaciones caucásicas. Esto refuerza su potencial para estratificar riesgos y guiar el manejo clínico en grupos diversos.
En conjunto, los biomarcadores derivados del análisis genético y epigenético de tejidos o biopsias constituyen herramientas prometedoras para mejorar el diagnóstico, pronóstico y personalización del tratamiento en el cáncer de próstata. Sin embargo, es fundamental continuar investigando en poblaciones variadas para validar estos hallazgos y comprender la influencia de factores genéticos, inmunológicos y ambientales en la enfermedad.
Límites biomarcadores
Aunque los análisis moleculares han impulsado el desarrollo de la oncología de precisión, el uso de biomarcadores predictivos enfrenta múltiples limitaciones. La estandarización de estos marcadores es compleja debido a la variabilidad en sus niveles de expresión según los procedimientos de laboratorio. Por ejemplo, la proteína PDL-1 muestra diferentes valores pronósticos en distintos tipos de tumores, y algunos pacientes responden a la inmunoterapia incluso sin expresar esta proteína. Diagnosticar una enfermedad metastásica puede ser difícil debido a la obtención complicada de muestras, especialmente cuando las metástasis se localizan en los huesos. Además, los análisis moleculares son costosos y requieren de asesoría genética para la detección de mutaciones hereditarias. Las pruebas de sangre solo identifican mutaciones en la línea germinal, mientras que los tejidos permiten estudiar tanto mutaciones somáticas como germinales. Se estima que más del 12 % de los hombres con cáncer de próstata metastásico tienen alteraciones genéticas hereditarias, mientras que más del 30 % presentan mutaciones somáticas. Sin embargo, las muestras de ADN tumoral circulante en sangre tienen menor sensibilidad que las obtenidas del tejido. Los avances recientes en diagnóstico por imagen, como la tomografía por emisión de positrones con antígeno prostático específico y la resonancia magnética multiparamétrica, no siempre son tenidos en cuenta en los estudios de biomarcadores. Además, la heterogeneidad intratumoral puede generar errores en el muestreo, afectando la fiabilidad de los biomarcadores basados en tejido. Aunque se ha logrado identificar variaciones genéticas asociadas al desarrollo de este cáncer, aún no es posible modificar estos genes para reducir la incidencia de la enfermedad ni su impacto en poblaciones de alto riesgo.
El descubrimiento de nuevos biomarcadores en el cáncer de próstata enfrenta desafíos técnicos, clínicos y económicos. Técnicamente, el desarrollo de un biomarcador ideal requiere un proceso riguroso que va desde su descubrimiento hasta su validación en estudios clínicos. Sin embargo, la mayoría de los biomarcadores generan resultados continuos, no dicotómicos, lo que dificulta distinguir con precisión entre tejido sano y enfermo. Además, las diferencias en el diseño de los estudios, las plataformas de prueba y la disponibilidad de muestras complican la replicación de resultados. Clínicamente, los biomarcadores deben aportar información adicional y autónoma frente a los métodos clínicos y patológicos existentes, pero faltan estudios comparativos que validen su efectividad y costo-beneficio en la práctica médica. Las diferencias en las mutaciones somáticas entre distintas metástasis y la baja sensibilidad de las pruebas de ADN tumoral circulante también limitan su utilidad. Económicamente, el alto costo de las pruebas moleculares y la necesidad de asesoramiento genético dificultan su adopción, especialmente en países en desarrollo, donde se siguen empleando métodos tradicionales de diagnóstico. Aunque las biopsias líquidas ofrecen una alternativa más accesible, la adopción generalizada de la terapia guiada por biomarcadores sigue limitada por estos obstáculos.
(publicidad)
Avances en el Tratamiento del Cáncer de Próstata: Inmunoterapia, Terapias con Células CAR-T y Modulación Metabólica
El cáncer de próstata puede tratarse mediante diversas estrategias, que incluyen enfoques estándar y tratamientos en investigación. Entre las opciones se encuentran las revisiones clínicas, recomendadas para hombres mayores sin síntomas graves. En estos casos, se monitoriza la evolución del cáncer sin intervención inmediata. Para aquellos con tumores localizados y buen estado de salud, la cirugía es una opción común; la prostatectomía radical, realizada por diferentes técnicas (abierta, laparoscópica o asistida por robot), permite extirpar la próstata y tejidos circundantes. Otras intervenciones quirúrgicas como la resección transuretral de próstata alivian síntomas urinarios. La radioterapia, ya sea externa o interna, utiliza radiación para destruir células cancerosas, aunque puede conllevar efectos secundarios urinarios y sexuales. Además, la terapia radiofarmacéutica con radioisótopos como el radio-223 es empleada cuando el cáncer se ha propagado al hueso.
Por otro lado, la terapia hormonal busca reducir o bloquear las hormonas sexuales masculinas que estimulan el crecimiento del cáncer, mediante medicamentos, cirugía o el uso de hormonas femeninas. La quimioterapia es utilizada para atacar células cancerosas diseminadas en el cuerpo, mientras que la terapia dirigida, como los inhibidores de PARP, se dirige a defectos genéticos específicos en las células cancerosas. La inmunoterapia, representada por tratamientos como Sipuleucel-T, estimula el sistema inmunitario para combatir el cáncer avanzado. Finalmente, los bifosfonatos se emplean para fortalecer los huesos y prevenir fracturas en pacientes cuyos cánceres se han diseminado al esqueleto. Participar en ensayos clínicos es una opción valiosa para acceder a terapias emergentes que podrían mejorar los resultados del tratamiento.
A continuación hablaremos de la inmunoterapia para acabar brevemente con los tratamientos experimentales
Desafíos y Avances en la Inmunoterapia para el Cáncer de Próstata
Aunque la inmunoterapia aún no ha logrado un éxito significativo en el tratamiento del cáncer de próstata, comprender a fondo las barreras inmunoterapéuticas específicas de esta enfermedad y seleccionar combinaciones adecuadas de medicamentos podrían ser la clave para su cura. Es fundamental entender bien el proceso de activación del sistema inmunológico para mejorar la eficacia de la inmunoterapia contra el cáncer. Entre las estrategias utilizadas para tratar el cáncer de próstata se encuentran el bloqueo de puntos de control inmunitarios, la potenciación de la muerte celular inmunogénica, la reversión del microambiente tumoral inmunosupresor, las vacunas contra el tumor, los adyuvantes inmunitarios, la terapia con células CAR-T y las intervenciones para superar las barreras de penetración dentro del microambiente tumoral. El bloqueo de puntos de control inmunitarios involucra moléculas co-inhibitorias como CTLA-4, PD-1 y PD-L1, que están altamente expresadas en células tumorales e inmunitarias, y que contribuyen a la supresión del sistema inmunológico y a la evasión del tumor. Bloquear estas moléculas es crucial para permitir que las células T del sistema inmunológico puedan atacar eficazmente a las células tumorales.
La monoterapia con bloqueo de puntos de control inmunitarios ha mostrado resultados limitados en el cáncer de próstata. Por ejemplo, el uso de ipilimumab, un anticuerpo monoclonal contra CTLA-4, ha generado algunos beneficios parciales, pero sin mejoras significativas en la supervivencia global de los pacientes. Otros tratamientos, como los inhibidores de PD-1 y PD-L1 (nivolumab, pembrolizumab, atezolizumab y avelumab), también han tenido respuestas modestas. Sin embargo, la combinación de nivolumab e ipilimumab ha mostrado una mayor eficacia, especialmente en pacientes con cáncer de próstata metastásico resistente a la castración. La eficacia de estos tratamientos aumenta cuando el cáncer presenta características moleculares específicas, como una alta carga mutacional del tumor, inestabilidad microsatelital alta o mutaciones en genes como CDK12, que favorecen una mayor respuesta inmunológica. Estos avances sugieren que combinar inmunoterapia con otras modalidades de tratamiento podría mejorar las perspectivas para pacientes con cáncer de próstata, aunque todavía se requiere más investigación para optimizar estas estrategias.
Las estrategias terapéuticas dirigidas a las células inmunosupresoras desempeñan un papel fundamental en la lucha contra el cáncer de próstata. Las principales poblaciones de estas células incluyen a los macrófagos asociados a tumores, las células supresoras derivadas de mieloides y las células T reguladoras. Estas células, mediante diferentes fenotipos y la liberación de factores señalizadores, interactúan entre sí y afectan el comportamiento de las células cancerosas, contribuyendo a la formación de un microambiente tumoral que suprime la respuesta inmune, favoreciendo el crecimiento y la diseminación del tumor. Para contrarrestar esto, se están desarrollando terapias que inhiben la reclutación, reprograman, eliminan o suprimen estas células inmunosupresoras, logrando que el microambiente tumoral adopte un perfil más inflamatorio y receptivo a los tratamientos inmunológicos. Por ejemplo, los macrófagos pueden polarizarse hacia un fenotipo proinflamatorio o antiinflamatorio; en el microambiente tumoral predominan los macrófagos antiinflamatorios que favorecen la supresión inmune. Bloquear ciertas vías de señalización que activan estos macrófagos permite reducir su presencia y cambiar su comportamiento hacia un estado que favorece la eliminación del tumor.
En el caso del cáncer de próstata, las células supresoras derivadas de mieloides son reclutadas al sitio tumoral, donde inhiben la respuesta inmune y protegen a las células cancerosas. Estas células liberan sustancias que activan vías relacionadas con la progresión del tumor y la resistencia a terapias hormonales. Su eliminación o bloqueo puede aumentar la infiltración de células T antitumorales y potenciar los efectos de la inmunoterapia. Por otro lado, las células T reguladoras están muy presentes en el cáncer de próstata y se asocian con un peor pronóstico. Estas células median la supresión inmune a través de la liberación de factores inmunosupresores y la expresión de moléculas inhibidoras. Al bloquear estas moléculas o reducir la acumulación de células T reguladoras en el tumor, se logra activar la respuesta inmune antitumoral, mejorando así la eficacia de los tratamientos. En conjunto, estas estrategias enfocadas en las células inmunosupresoras representan una vía prometedora para mejorar el tratamiento y pronóstico del cáncer de próstata."
Inmunoterapia en base a vacunas
La vacuna sipuleucel-T es una terapia celular autóloga dirigida a proteínas específicas de la próstata, y representa la primera vacuna aprobada para tratar tumores por la Administración de Alimentos y Medicamentos. Esta vacuna está recomendada como tratamiento inicial para el cáncer de próstata metastásico resistente a la castración. El procedimiento consiste en recolectar células mononucleares de la sangre periférica del paciente, incubarlas con un antígeno específico de la próstata llamado PA2024, y luego reinfundir estas células dendríticas activadas en el paciente. Este proceso activa las células T, las cuales reconocen y eliminan las células tumorales que expresan fosfatasa ácida prostática, inhibiendo el crecimiento tumoral.
Los estudios han demostrado que la vacuna sipuleucel-T prolonga la mediana de supervivencia global y reduce el riesgo de muerte en pacientes con cáncer de próstata metastásico resistente a la castración. Aunque no afecta significativamente la supervivencia libre de progresión, esta vacuna mejora la presentación del antígeno y activa linfocitos T que se infiltran en el tumor, modificando el microambiente tumoral hacia un estado proinflamatorio. Además, genera una memoria inmune duradera, lo que la convierte en una candidata ideal para combinar con otras inmunoterapias, como bloqueos de puntos de control inmunitarios y radioterapia.
La combinación de sipuleucel-T con la terapia con radio 223 en el tratamiento del cáncer de próstata metastásico resistente a la castración mostró resultados prometedores. Aunque la respuesta específica de células T a PA2024 fue menor que con sipuleucel-T solo, el grupo con terapia combinada presentó una mayor proporción de pacientes con reducción significativa del antígeno prostático específico, además de mejorar la supervivencia libre de progresión y la supervivencia global. Sin embargo, algunos pacientes experimentaron efectos adversos relacionados con el sistema inmunitario cuando esta vacuna se combinó con bloqueadores de puntos de control inmunitarios.
Para mejorar la eficacia del tratamiento, se ha investigado la combinación de sipuleucel-T con interleucinas recombinantes humanas, que son proteínas que modulan la respuesta inmunitaria. El tratamiento combinado con interleucina-7 aumentó la proliferación de células T CD4+, CD8+ y células asesinas naturales, mejoró la respuesta humoral al antígeno y aumentó la expresión de marcadores proinflamatorios. Esto se tradujo en un beneficio clínico favorable, evidenciado por una mayor demora en la duplicación del antígeno prostático específico. De manera similar, la interleucina-15 potenció la activación y expansión de células T y células NKT productoras de interferón gamma, mejorando la respuesta antitumoral.
El diseño de vacunas basadas en células dendríticas se basa en la capacidad de estas células para presentar antígenos a los linfocitos T. Se utilizan células dendríticas maduras y sus componentes de membrana para activar selectivamente las células T. Recientemente, se han desarrollado nanovacunas basadas en membranas de células dendríticas que pueden presentar autoantígenos y revertir la inhibición inmunitaria. Al infectar estas células con adenovirus recombinantes, se generan complejos péptido-moléculas del complejo mayor de histocompatibilidad clase I que activan directamente los linfocitos T citotóxicos CD8+.
Otras estrategias incluyen la creación de nanovacunas que modifican anticuerpos contra PD-1 en las membranas de células dendríticas, conocidas como ASPIRE. Estas nanovacunas inhiben el crecimiento tumoral, revierten la fatiga de las células T CD8+ y promueven la formación de células de memoria central y efectora, previniendo la recurrencia tumoral. Además, la incubación de lisados celulares de cáncer de mama triple negativo con células dendríticas inmaduras permite obtener nanovesículas que, al administrarse con células mononucleares de sangre periférica, aumentan la infiltración de células T y promueven la apoptosis tumoral en modelos animales.
Por último, las vacunas basadas en membranas de células tumorales representan una estrategia prometedora para activar respuestas inmunitarias específicas. Estas membranas contienen múltiples antígenos tumorales y pueden combinarse con nanopartículas y adyuvantes inmunitarios para mejorar la eficacia. En cánceres como el cáncer de próstata, que tienden a ser tumores "fríos" con baja inmunogenicidad, estas vacunas pueden inducir respuestas inmunitarias específicas que retrasan el crecimiento y la metástasis tumoral. La combinación con terapias que bloquean la proteína PD-1 potencia aún más la supresión del tumor, abriendo nuevas posibilidades para terapias personalizadas y tratamientos clínicos futuros
Inmunoterapia y adyuvantes
Los adjuvantes mejoran la respuesta inmunitaria activando el sistema inmune a través de receptores tipo Toll en células inmunitarias innatas, como fagocitos, células dendríticas y células asesinas naturales. Estos facilitan el procesamiento y la presentación de antígenos, aumentan la inmunogenicidad de los antígenos y potencian las respuestas inmunes. Entre los adjuvantes inmunológicos más usados se encuentran compuestos como imiquimod, resiquimod, monofosforil lípido A, ácido poliinosinico-policitidílico y oligodesoxinucleótidos CpG, que actúan sobre diferentes receptores Toll y se emplean en la preparación de vacunas contra el cáncer y en el desarrollo de nanomateriales terapéuticos para tumores. Por ejemplo, nanopartículas recubiertas con membranas celulares de cáncer de próstata y cargadas con imiquimod muestran una maduración aumentada de células dendríticas y mayor secreción de citocinas importantes, además de una mejor llegada a los ganglios linfáticos y una inhibición significativa del crecimiento tumoral, junto con un incremento de linfocitos T citotóxicos en el tumor. De manera similar, vesículas extracelulares derivadas de células de cáncer de próstata cargadas con compuestos adjuvantes aumentan la proporción de células dendríticas estimuladoras, linfocitos T citotóxicos y macrófagos proinflamatorios en el sitio tumoral, mientras que reducen las células reguladoras inmunosupresoras y macrófagos antiinflamatorios. Además, la organización espacial de los antígenos tumorales y los adjuvantes en los nanomateriales influye en la activación de la inmunidad adaptativa, como se observa en ácidos nucleicos esféricos inmunoestimuladores que presentan simultáneamente el antígeno y el adjuvante en la superficie de liposomas, mejorando la activación de células dendríticas y la respuesta citotóxica específica contra el cáncer de próstata. Aunque el uso de adjuvantes para potenciar la inmunoterapia ha mostrado resultados prometedores en estudios preclínicos, aún existen preocupaciones sobre su toxicidad inespecífica en tejidos y órganos normales.
Inmunoterapia en base a células CAR-T
La terapia CAR-T es un campo fundamental en la inmunoterapia contra tumores. Esta técnica está diseñada para identificar y destruir de manera selectiva las células que presentan en su superficie ciertos antígenos específicos. Ha demostrado resultados prometedores en el tratamiento de neoplasias hematológicas y podría ser una opción eficaz para tratar tumores sólidos, como el cáncer de próstata, en el futuro. Las células CAR-T reconocen sus células objetivo sin depender del complejo mayor de histocompatibilidad y contienen moléculas quiméricas compuestas por un dominio de reconocimiento de antígeno, una región bisagra, un dominio transmembrana y un dominio de señalización intracelular. Según los dominios coestimuladores presentes, se clasifican en varias generaciones. Cuando la molécula CAR se une a los antígenos homólogos en la superficie de las células tumorales, las células CAR-T se activan, provocando la destrucción de estas células y la producción de citocinas que estimulan la proliferación celular.
Las células CAR-T se desarrollan a partir de los linfocitos T del propio paciente, lo que permite una acción específica contra las células tumorales. En estudios clínicos, la terapia CAR-T dirigida a antígenos como la molécula específica de membrana prostática, el antígeno de células del cáncer de próstata y la molécula de adhesión celular epitelial ha mostrado actividad antitumoral en pacientes con cáncer de próstata. Sin embargo, la eficacia de esta terapia puede verse afectada por el microambiente inmunosupresor del tumor, que incluye células inmunosupresoras y citocinas que inhiben la función de los linfocitos citotóxicos. Por ello, se han desarrollado células CAR-T resistentes a estas condiciones adversas, como aquellas insensibles al factor de crecimiento transformante beta, que han demostrado mejores resultados en modelos tumorales. Ensayos clínicos tempranos han mostrado la viabilidad y seguridad de estas células en el tratamiento del cáncer de próstata resistente a la castración, aunque con algunos efectos secundarios significativos. Además, la precondición con ciertos fármacos puede mejorar la infiltración y eficacia de las células CAR-T en tumores sólidos. A pesar de los desafíos asociados, como la toxicidad derivada de la depleción linfocitaria previa y la expresión de antígenos en tejidos normales, se busca optimizar el diseño de estas células para mejorar su especificidad, persistencia y seguridad en el combate contra el cáncer de próstata.
(publicidad)
Desarrollos en Medicina Personalizada y Tratamientos para el Cáncer de Próstata
Actualmente, el mundo está experimentando avances rápidos en los campos de la salud y los tratamientos médicos personalizados. La implementación de tecnologías de alto rendimiento ha impulsado la bioinformática traslacional, una ciencia que se encarga de obtener, procesar y almacenar datos para mejorar la salud humana. Estas tecnologías han facilitado el desarrollo de planes de tratamiento personalizados para pacientes individuales, con el objetivo de maximizar sus posibilidades de recuperación. En el caso del cáncer de próstata, algunas formas resultan de mutaciones genéticas específicas que pueden hacer que ciertos tratamientos sean ineficaces. Por ello, es crucial identificar las mutaciones presentes en cada paciente para determinar la terapia más adecuada. Sin embargo, es importante destacar que la implementación de medicinas personalizadas enfrenta desafíos en países en desarrollo debido a la falta de infraestructura médica adecuada, lo que limita el acceso a estos tratamientos y contribuye a tasas de mortalidad más elevadas en comparación con países desarrollados.
Planes de Tratamiento Basados en el Metabolismo
Para comprender los tratamientos metabólicos en el cáncer de próstata, es fundamental conocer cómo funcionan los principales sustratos metabólicos en la próstata sana. Entre ellos destacan el citrato, la glucosa, los ácidos grasos y la glutamina. En las células prostáticas normales, el citrato se produce y se secreta para contribuir a la formación del semen, a diferencia de otras células donde se oxida para obtener energía. La glucosa, por su parte, se transforma en piruvato mediante la glucólisis, y la mayor parte de este piruvato ingresa a las mitocondrias para participar en el ciclo de Krebs, que genera el citrato necesario para la función prostática.
El citrato juega un papel clave en la próstata. En las células normales, un transportador llamado ZIP1 introduce zinc, que inhibe una enzima mitocondrial encargada de oxidar el citrato. Esta regulación provoca que la energía se obtenga mayormente por glucólisis aeróbica y no por fosforilación oxidativa. En contraste, en las células cancerosas la expresión de ZIP1 disminuye, reduciendo la producción de citrato y aumentando la actividad enzimática que lo oxida. Esto genera más energía para favorecer el crecimiento tumoral. Un enfoque terapéutico potencial es el uso de clioquinol, un compuesto que facilita la entrada de zinc en las células cancerosas, inhibiendo su proliferación.
La glucosa es la principal fuente de energía para las células, procesándose normalmente para obtener energía mediante fosforilación oxidativa en el ciclo de Krebs. Cuando falta oxígeno, se convierte en lactato a través de la glucólisis anaeróbica. En el cáncer de próstata, las células aumentan la actividad del ciclo de Krebs para aprovechar mejor la glucosa, promoviendo su crecimiento. Aunque el efecto Warburg, que implica una glucólisis aeróbica acelerada, es común en muchos cánceres, en este cáncer aparece solo en etapas avanzadas resistentes a la castración. Se están desarrollando compuestos que interrumpen esta vía para tratar células resistentes, y la señalización del receptor de andrógenos potencia la captación de glucosa, facilitando la proliferación tumoral.
El cáncer de próstata activa la síntesis de ácidos grasos mediante un proceso llamado lipogénesis de novo, ausente en células normales. Esta síntesis es crucial para la supervivencia y multiplicación del tumor. El medicamento etomoxir, que bloquea la oxidación de ácidos grasos, reduce el crecimiento celular tumoral. Además, esta activación metabólica está relacionada con la resistencia a tratamientos como la enzalutamida, un inhibidor del receptor de andrógenos. Sin embargo, combinar enzalutamida con un inhibidor de la síntesis de ácidos grasos ha mostrado mayor eficacia que usar cada uno por separado.
Por último, la glutamina es un sustrato esencial en formas agresivas del cáncer de próstata, ya que su metabolismo, la glutaminólisis, mantiene el equilibrio de nitrógeno y carbono en el ciclo de Krebs. En este cáncer, los transportadores de glutamina están sobreexpresados, aumentando su captación gracias a la influencia del receptor de andrógenos y promoviendo el crecimiento descontrolado. El fármaco L-asparaginasa, empleado en leucemias, puede disminuir la glutamina en las células cancerosas, haciéndolas más sensibles a la radioterapia y mejorando el control del tumor.
Métodos de Tratamiento Basados en la Inflamación
La inflamación está estrechamente asociada con varios tipos de cáncer, incluido el cáncer de próstata. Factores ambientales como la obesidad, la dieta y el microbioma individual contribuyen a la inflamación crónica, que puede actuar como un catalizador para el crecimiento tumoral. Aunque a menudo se considera un síntoma, la inflamación también puede ser una causa del cáncer de próstata, ya que el daño en el ADN debido a especies reactivas de oxígeno y la secreción de moléculas inflamatorias promueven el desarrollo y la diseminación del tumor. Por ello, los agentes antiinflamatorios podrían ser útiles como parte del tratamiento.
Diversos tipos de células inmunitarias inflamatorias, como los macrófagos asociados a tumores, neutrófilos asociados a tumores y células supresoras derivadas de la médula ósea, juegan roles importantes en la progresión del cáncer de próstata. Los macrófagos pueden promover el crecimiento tumoral y la inestabilidad genética, pero reeducarlos para que actúen contra el tumor podría ser una estrategia terapéutica efectiva. En este sentido, antagonistas de receptores específicos de quimiocinas han mostrado bloquear la progresión tumoral y mejorar la respuesta inmune. Por otro lado, neutrófilos y células supresoras inmunitarias también influyen en la supervivencia del cáncer, y algunos tratamientos dirigidos a modificar su actividad han demostrado promover la regresión tumoral y aumentar la eficacia de terapias contra el cáncer.
Métodos de Tratamiento Basados en la Familia Enzimática Citocromo P450
La familia de enzimas Citocromo P450 está formada por múltiples genes que codifican enzimas responsables de la hidroxilación de compuestos utilizando oxígeno y un cofactor llamado NADPH. Algunas de estas enzimas participan en el metabolismo de lípidos como ácidos grasos y colesterol, así como en la activación y degradación de moléculas como la vitamina D y los andrógenos. Alteraciones en la expresión o función de estas enzimas pueden contribuir al desarrollo y progresión del cáncer de próstata.
En particular, una enzima llamada CYP2R1 convierte la vitamina D en una forma activa que tiene efectos antitumorales. La reducción de esta enzima puede aumentar el riesgo de cáncer. Por otro lado, enzimas como CYP3A y CYP2B6 participan en el metabolismo de la testosterona, un andrógeno clave en el desarrollo del cáncer de próstata. La disminución de estas enzimas puede incrementar la actividad del receptor de andrógenos, favoreciendo el crecimiento tumoral y la resistencia a tratamientos hormonales. Además, la biosíntesis de testosterona depende de otras enzimas de la familia Citocromo P450, como CYP17A1 y CYP11A1, cuyas alteraciones genéticas están relacionadas con una mayor progresión de la enfermedad.
El uso de inhibidores específicos de estas enzimas esteroidogénicas ha demostrado reducir la producción de testosterona, mejorando la efectividad de los tratamientos contra el cáncer de próstata cuando se utilizan en combinación.
Referencias
Bergengren O, Pekala KR, Matsoukas K, Fainberg J, Mungovan SF, Bratt O, Bray F, Brawley O, Luckenbaugh AN, Mucci L, Morgan TM, Carlsson SV. 2022 Update on Prostate Cancer Epidemiology and Risk Factors-A Systematic Review. Eur Urol. 2023 Aug;84(2):191-206
Wilson TK, Zishiri OT. Prostate Cancer: A Review of Genetics, Current Biomarkers and Personalised Treatments. Cancer Rep (Hoboken). 2024 Oct;7(10):e70016
Liu D, Wang L, Guo Y. Advances in and prospects of immunotherapy for prostate cancer. Cancer Lett. 2024 Oct 1;601:217155.
Rafikova G, Gilyazova I, Enikeeva K, Pavlov V, Kzhyshkowska J. Prostate Cancer: Genetics, Epigenetics and the Need for Immunological Biomarkers. Int J Mol Sci. 2023
Boehm BE, York ME, Petrovics G, Kohaar I, Chesnut GT. Biomarkers of Aggressive Prostate Cancer at Diagnosis. Int J Mol Sci. 2023 Jan 22;24(3):2185
Das S, Ganguly SC, Bera S, Kundu M. Advance in prostate cancer biomarker discovery: bridging detection, prognosis and therapeutics. Discov Oncol. 2025 May 30;16(1):954
Mughees M, Kaushal JB, Sharma G, Wajid S, Batra SK, Siddiqui JA. Chemokines and cytokines: Axis and allies in prostate cancer pathogenesis. Semin Cancer Biol. 2022 Nov;86(Pt 3):497-512
Leslie SW, Soon-Sutton TL, Skelton WP. Prostate Cancer. 2024 Oct 4. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan–
PDQ Screening and Prevention Editorial Board. Prostate Cancer Screening (PDQ®): Patient Version. 2024 Dec 10. In: PDQ Cancer Information Summaries [Internet]. Bethesda (MD): National Cancer Institute (US); 2002–
PDQ Adult Treatment Editorial Board. Prostate Cancer Treatment (PDQ®): Patient Version. 2024 Dec 20. In: PDQ Cancer Information Summaries [Internet]. Bethesda (MD): National Cancer Institute (US); 2002–
PDQ Integrative, Alternative, and Complementary Therapies Editorial Board. Prostate Cancer, Nutrition, and Dietary Supplements (PDQ®): Health Professional Version. 2024 Dec 20. In: PDQ Cancer Information Summaries [Internet]. Bethesda (MD): National Cancer Institute (US); 2002–