Glaucoma: Una Visión General de una Enfermedad Silenciosa
José Hernández Jiménez
3/11/202539 min leer
Glaucoma: Una Visión General de una Enfermedad Silenciosa
Introducción
El glaucoma es una de las principales causas de ceguera irreversible en todo el mundo. Se estima que en 2020 alrededor de 79.6 millones de personas padecían esta enfermedad, y se espera que la cifra supere los 111.8 millones para 2040. En China, el glaucoma de ángulo cerrado es más común que el de ángulo abierto y, además, tiene una mayor tasa de ceguera. Esta enfermedad afecta diferentes partes del ojo, incluyendo la córnea, que es la estructura transparente en la parte frontal del ojo y es fundamental para la visión.
Gracias a los avances tecnológicos en oftalmología, hoy contamos con diversas herramientas para examinar la córnea y detectar cambios relacionados con el glaucoma. Métodos como la tomografía de coherencia óptica del segmento anterior (AS-OCT) y la microscopía confocal in vivo (IVCM) permiten analizar la estructura de la córnea de manera precisa y sin contacto, proporcionando información valiosa sobre los efectos del glaucoma en esta parte del ojo.
A nivel global, el glaucoma afecta a aproximadamente 95 millones de personas, de las cuales cerca de 10 millones han perdido la visión en al menos un ojo. Esta enfermedad se caracteriza por la degeneración progresiva de las células ganglionares de la retina y sus fibras nerviosas, lo que lleva a una pérdida irreversible de la visión. Aunque reducir la presión intraocular (PIO) es la estrategia principal para retrasar su progresión, todavía no se comprende completamente su mecanismo de desarrollo.
La investigación ha demostrado que el envejecimiento celular juega un papel clave en el glaucoma. A medida que envejecemos, se producen cambios en el sistema de drenaje del ojo, lo que dificulta la salida del humor acuoso y puede aumentar la presión intraocular. Además, el estrés oxidativo y los daños en el ADN pueden contribuir al deterioro de las células del ojo, acelerando el avance de la enfermedad.
Históricamente, el conocimiento sobre el glaucoma ha evolucionado con el desarrollo de nuevas tecnologías. En la antigüedad, ya se observaban síntomas como dolor ocular y pérdida de visión, aunque no se identificaba la enfermedad como tal. Con la invención del tonómetro en el siglo XIX y del oftalmoscopio en la década de 1850, los médicos pudieron medir la presión ocular y examinar el nervio óptico, lo que permitió una mejor comprensión del glaucoma. A lo largo del siglo XX, se introdujeron pruebas de campo visual y dispositivos automáticos de tonometría, facilitando un diagnóstico más preciso. En la actualidad, técnicas avanzadas como la tomografía de coherencia óptica (OCT) y la tonometría domiciliaria han mejorado significativamente la detección y el seguimiento de la enfermedad.
Un aspecto clave en el diagnóstico del glaucoma es el grosor de la córnea, ya que influye en la medición de la presión intraocular. Las córneas más delgadas pueden subestimar la PIO, mientras que las más gruesas pueden sobreestimarla, lo que puede llevar a diagnósticos inexactos. Por ello, la paquimetría corneal —una técnica para medir el grosor de la córnea— se ha convertido en una herramienta valiosa en la evaluación del riesgo de glaucoma.
El glaucoma es una enfermedad silenciosa, ya que en sus etapas iniciales no presenta síntomas evidentes. Para cuando la visión se ve afectada, el daño suele ser irreversible. Por esta razón, es fundamental realizar exámenes oftalmológicos periódicos, especialmente en personas mayores de 50 años o con factores de riesgo. A medida que avanzamos en la investigación sobre el envejecimiento celular y su relación con el glaucoma, también exploramos nuevas formas de tratamiento que podrían frenar la progresión de esta enfermedad y preservar la visión de millones de personas en el mundo.
Anatomía y Fisiología del Ojo: Regulación de la Presión Intraocular
El ojo humano es un órgano esférico ubicado en las órbitas del cráneo y su función principal es detectar la luz para permitir la visión. Su estructura está formada por tres capas principales de tejido, cada una con funciones esenciales:
Capa externa: Compuesta por la córnea, una estructura transparente y sin vasos sanguíneos que facilita el paso de la luz hacia el interior del ojo, y la esclerótica, la parte blanca del ojo que le da forma y protección.
Capa media o úvea: Incluye el iris, que controla la cantidad de luz que entra al ojo a través de la pupila; el cuerpo ciliar, que produce el humor acuoso y permite el enfoque del cristalino; y la coroides, una capa rica en vasos sanguíneos que nutre la retina.
Capa interna: Formada por la retina, donde se encuentran las células sensibles a la luz (conos y bastones), encargadas de convertir las señales luminosas en impulsos eléctricos que el cerebro interpreta como imágenes.
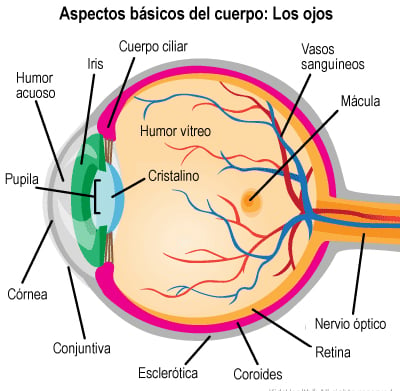
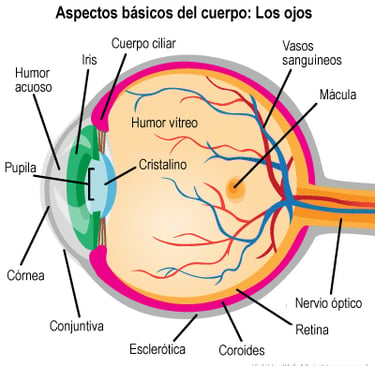
Imagen: childrensmn.org
El interior del ojo contiene dos líquidos esenciales: el humor acuoso y el humor vítreo.
El humor acuoso es un líquido transparente producido en el cuerpo ciliar. Su función es mantener la presión intraocular y nutrir estructuras como la córnea y el cristalino. Se drena principalmente a través del canal de Schlemm.
El humor vítreo es una sustancia gelatinosa que se encuentra en la parte posterior del ojo y ayuda a mantener su forma. A diferencia del humor acuoso, su renovación es muy lenta.
La presión intraocular (PIO) es el equilibrio entre la producción y el drenaje del humor acuoso. En una persona sana, esta presión se mantiene entre 12 y 20 mmHg. Si el drenaje del humor acuoso se ve afectado, la presión aumenta, lo que puede dañar el nervio óptico y provocar glaucoma.
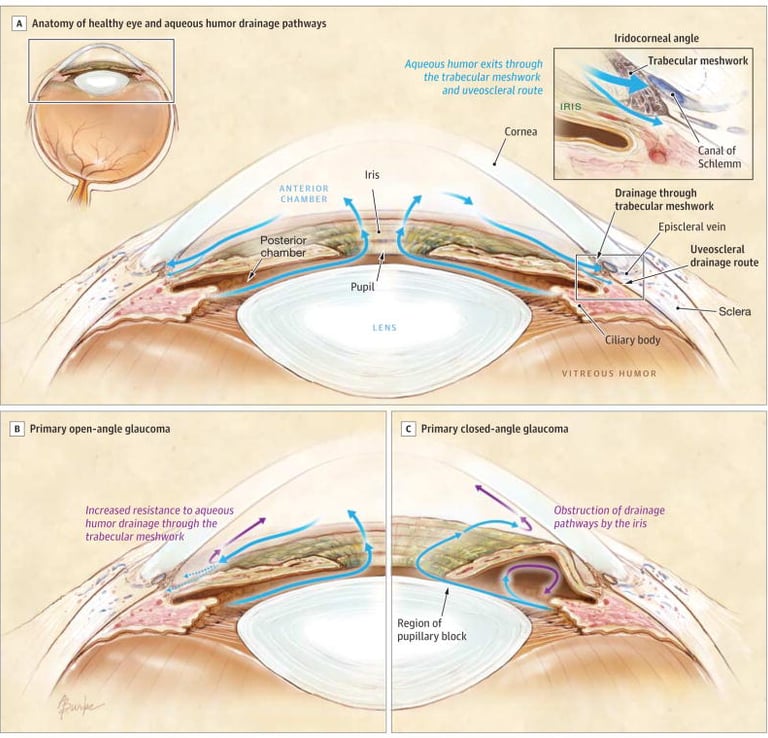
IMAGEN: Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA. 2014 May 14;311(18):1901-11
Glaucoma e hipertensión ocular
El glaucoma es una enfermedad ocular caracterizada por un aumento de la presión intraocular, lo que comprime el nervio óptico y puede causar pérdida de visión irreversible. Existen dos tipos principales de glaucoma:
Glaucoma de ángulo abierto: Es el tipo más común. Se produce cuando el canal de drenaje del humor acuoso se obstruye de forma progresiva, impidiendo su eliminación y generando un aumento lento de la presión intraocular. Este proceso no suele presentar síntomas en sus etapas iniciales, por lo que muchas personas no lo detectan hasta que ya hay daño visual significativo.
Glaucoma de ángulo cerrado: Es menos frecuente, pero más agresivo. Se produce cuando el ángulo entre la córnea y el iris se cierra repentinamente, bloqueando por completo la salida del humor acuoso. Esto provoca un aumento brusco de la presión ocular, generando síntomas graves como dolor intenso, visión borrosa y náuseas. Requiere atención médica inmediata para evitar daños irreversibles en el ojo.
El glaucoma es una de las principales causas de ceguera irreversible en el mundo. Por ello, es fundamental comprender la fisiología del ojo y la importancia del equilibrio en la producción y eliminación del humor acuoso para prevenir esta enfermedad. La detección temprana y el tratamiento adecuado pueden ayudar a preservar la visión en personas con riesgo de desarrollar glaucoma.
Diagnóstico del Glaucoma: De lo usual a lo Emergente
Importancia del Grosor Corneal en la Medición de la Presión Intraocular
La presión intraocular es uno de los principales factores de riesgo del glaucoma y se mide comúnmente con la tonometría de aplanación de Goldmann (GAT). Sin embargo, la medición de la PIO puede verse afectada por el grosor central de la córnea (CCT, por sus siglas en inglés).
Córneas más delgadas pueden dar valores subestimados de la PIO, lo que podría llevar a un retraso en el diagnóstico del glaucoma.
Córneas más gruesas pueden generar lecturas sobreestimadas, lo que puede hacer que algunos pacientes sean tratados innecesariamente por hipertensión ocular.
Por esta razón, la medición del grosor corneal mediante paquimetría es fundamental para interpretar correctamente la PIO y evaluar el riesgo real de glaucoma.
Paquimetría: Herramienta Clave en el Diagnóstico del Glaucoma
La paquimetría es una técnica que mide el grosor de la córnea y puede realizarse con diferentes métodos:
Paquimetría ultrasónica, la más común en entornos clínicos, utiliza ondas sonoras para medir la córnea.
Tomografía corneal, que emplea tecnología avanzada como la imagen de Scheimpflug o la tomografía de coherencia óptica (OCT), permitiendo obtener imágenes detalladas del segmento anterior del ojo.
Estos métodos no solo ayudan a ajustar la medición de la PIO, sino que también permiten detectar condiciones corneales que podrían influir en la evolución del glaucoma.
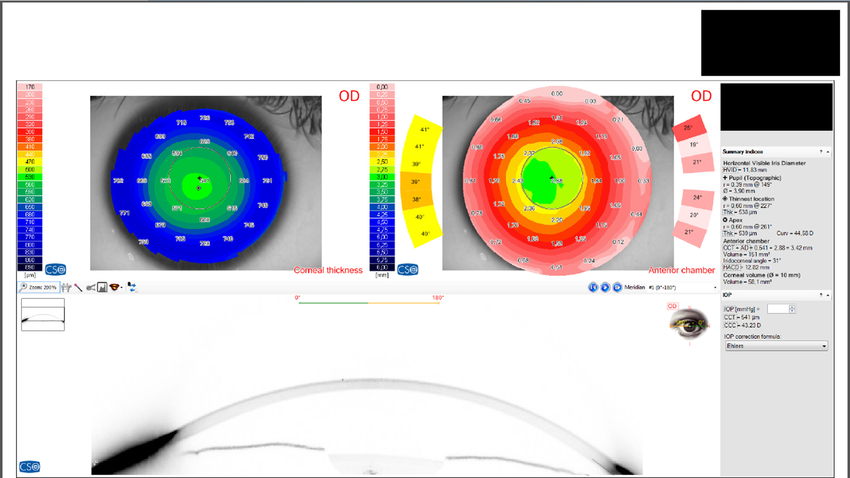
imagen de Scheimpflug en el diagnóstico de un glaucoma (Prakash, G.; Srivastava, D. Single session, intrauser repeatability of anterior chamber biometric and corneal pachy-volumetric parameters using a new Scheimpflug. Journal of Optometry)
Evaluación del Riesgo de Glaucoma con la Paquimetría
Dado que una córnea más delgada es un factor de riesgo independiente para el glaucoma, la medición de su grosor es crucial para identificar a pacientes en riesgo. Estudios como el Ocular Hypertension Treatment Study (OHTS) han demostrado que las personas con córneas más delgadas (≤ 555 µm) tienen hasta tres veces más riesgo de desarrollar glaucoma en comparación con aquellas con córneas más gruesas (> 588 µm).
Para mejorar la detección del glaucoma, herramientas como la calculadora de riesgo de glaucoma de Laroche combinan variables como la edad, la PIO y el grosor corneal para estimar el riesgo de la enfermedad con una alta precisión (92% de sensibilidad y 90% de especificidad). Esta herramienta permite una evaluación más objetiva y puede ser utilizada incluso por personal médico no especializado.
Herramientas Emergentes para el Diagnóstico del Glaucoma
En los últimos años, han surgido avances significativos en las herramientas utilizadas para el diagnóstico del glaucoma, lo que permite una detección más precisa y temprana de la enfermedad. Una de las innovaciones más destacadas es el protocolo SITA Faster 24-2C (SFR-C) dentro de la perimetría automatizada estándar (SAP). Este protocolo mejora las pruebas tradicionales, como los protocolos 24-2 y 30-2, al incluir diez puntos adicionales en la zona macular, lo que es crucial para la visión cotidiana. El SFR-C también reduce la duración de las pruebas, mejorando la fiabilidad y reduciendo la fatiga del paciente, sin comprometer la precisión de los resultados, que son comparables con otros protocolos más extensos.
Además, el uso de dispositivos de realidad virtual (VR) ha facilitado el acceso a la evaluación del campo visual. Las aplicaciones, como la Melbourne Rapid Fields (MRF), permiten realizar pruebas rápidas de campo visual con una mínima inversión en equipamiento. MRF ofrece dos modalidades: una prueba completa de 4 a 5 minutos por ojo y una prueba rápida de 90 segundos, lo que es ideal en situaciones con recursos limitados. Esta herramienta permite a los profesionales de la salud realizar un cribado eficaz del glaucoma en comunidades donde el acceso a equipos costosos es limitado, mejorando la cobertura diagnóstica.
La perimetría de realidad virtual (VRP) es otra herramienta innovadora que ha ganado relevancia en los entornos clínicos. Dispositivos como VIP Visual Fields y Vivid Vision Perimetry utilizan tecnología de realidad virtual para mapear los defectos en el campo visual de los pacientes. Estos sistemas son más accesibles y fáciles de usar en comparación con los equipos tradicionales, lo que facilita su integración en prácticas clínicas y proporciona una evaluación precisa del daño visual en pacientes con glaucoma.
Finalmente, la angiografía OCT (OCTA) ha emergido como una tecnología avanzada para estudiar los vasos sanguíneos y la perfusión capilar en la retina, lo que permite detectar alteraciones tempranas asociadas al glaucoma. Combinando la tomografía de coherencia óptica (SDOCT) con información detallada sobre la microvasculatura en el área del nervio óptico y la zona peripapilar, la OCTA proporciona una visión más completa del daño potencial, ayudando a identificar cambios antes de que se produzcan alteraciones significativas en el nervio óptico. Esta herramienta no solo contribuye al diagnóstico, sino que también permite seguir la progresión de la enfermedad y evaluar el riesgo de futuro daño neuronal.
Uso de la Inteligencia Artificial (IA) en el diagnóstico del glaucoma
El diagnóstico temprano del glaucoma es fundamental para prevenir la pérdida irreversible de la visión. A medida que la tecnología avanza, la inteligencia artificial (IA) ha emergido como una herramienta prometedora para mejorar la precisión y eficiencia en la detección y diagnóstico del glaucoma. El uso de IA, combinado con el análisis de grandes volúmenes de datos, está revolucionando el diagnóstico de esta enfermedad ocular, permitiendo detectar cambios en los patrones de la enfermedad en sus etapas más tempranas. Sin embargo, aunque la IA ha demostrado ser eficaz en muchos aspectos, aún enfrenta obstáculos en cuanto a su aprobación y aplicación clínica.
Avances en el análisis de imágenes con IA
Una de las aplicaciones más destacadas de la IA en el diagnóstico del glaucoma es su capacidad para analizar imágenes del fondo de ojo y tomografía de coherencia óptica (OCT). La IA puede procesar estas imágenes con una velocidad y precisión superiores a las de los métodos tradicionales, ayudando a detectar signos tempranos de daño en el nervio óptico, característico del glaucoma. Este análisis automatizado reduce la carga de trabajo de los profesionales de la salud, permitiéndoles centrarse en casos más complejos y optimizando la toma de decisiones.
En el caso de la OCT, un avance significativo es la capacidad de los algoritmos de IA para examinar la morfología del nervio óptico, identificando estructuras y características que podrían pasar desapercibidas para un ojo humano. Esto facilita la clasificación de los discos ópticos como “referibles”, es decir, aquellos que requieren una evaluación más profunda por parte de un especialista. Aunque los algoritmos aplicados a la OCT no son tan simples como los que se usan para analizar imágenes de fondo de ojo debido a las diferencias en la adquisición y el registro de las imágenes, estos avances representan un paso hacia un diagnóstico más rápido y preciso.
Limitaciones de la IA en el diagnóstico del glaucoma
A pesar de sus avances, la IA aún enfrenta varios desafíos. Un obstáculo importante es la variabilidad en los resultados de las mediciones, lo que puede dificultar la interpretación precisa de las imágenes del nervio óptico. Factores como la variabilidad en el grosor de la capa de fibras nerviosas (RNFL), el efecto de la refracción ocular y la longitud axial del ojo pueden influir en los resultados de los diagnósticos generados por los algoritmos de IA. Además, aunque los sistemas de IA han demostrado ser útiles para predecir la pérdida de visión, especialmente en pacientes que no pueden someterse a pruebas de campo visual tradicionales, no se puede confiar plenamente en ellos para hacer un diagnóstico definitivo de glaucoma en todos los casos.
La IA en el screening de glaucoma
El screening masivo de glaucoma es un desafío importante debido a la prevalencia de la enfermedad y la necesidad de detectar los casos en sus primeras etapas. En este sentido, la IA está demostrando ser una herramienta valiosa. La combinación de la IA con técnicas de imagen de bajo costo, como la fotografía del fondo de ojo, permite identificar signos de daño en el nervio óptico de manera rápida y económica. Esto puede aumentar la accesibilidad al diagnóstico, especialmente en regiones con recursos limitados.
Al utilizar IA para analizar imágenes del fondo de ojo, los algoritmos pueden identificar características específicas del glaucoma, tales como la excavación del disco óptico o los cambios en los vasos peripapilares. Estos avances hacen posible detectar la enfermedad en una fase temprana, antes de que se presenten síntomas clínicos graves. Además, la IA también puede ser utilizada para analizar la presión intraocular (PIO), un factor clave en la detección temprana del glaucoma.
Mejora de la precisión diagnóstica con IA y OCT
La tomografía de coherencia óptica (OCT) es una de las herramientas más avanzadas en el diagnóstico del glaucoma, y la incorporación de IA ha mejorado su precisión. Los algoritmos de IA pueden procesar las imágenes obtenidas mediante OCT para detectar signos de daño en la estructura ocular, como el adelgazamiento de la capa de fibras nerviosas. Esto facilita la identificación de pacientes con riesgo de glaucoma y ayuda a realizar un diagnóstico más preciso.
En estudios recientes, se ha demostrado que la combinación de OCT y algoritmos de IA mejora significativamente la detección del glaucoma. Los modelos de IA analizan los patrones de las imágenes de OCT, buscando anomalías que indican un daño temprano en el nervio óptico. Este enfoque complementario permite a los médicos obtener una visión más completa y precisa del estado ocular de los pacientes, mejorando la capacidad de diagnóstico.
La IA y la segmentación del nervio óptico
Otro aspecto clave en el uso de la IA para el diagnóstico del glaucoma es su capacidad para realizar segmentación automática de las imágenes del nervio óptico. La segmentación implica dividir las imágenes en áreas de interés, lo que permite analizar de manera más detallada las diferentes estructuras dentro del nervio óptico y la retina. Con el uso de algoritmos de aprendizaje profundo, la IA puede segmentar las imágenes de OCT con alta precisión, identificando cambios sutiles que podrían ser indicativos de glaucoma.
La segmentación automática también reduce la carga de trabajo de los especialistas, que de otra manera tendrían que examinar manualmente cada imagen. Además, al mejorar la precisión en la segmentación de las estructuras oculares, la IA facilita la detección temprana de anomalías, lo que permite iniciar el tratamiento antes de que se produzcan daños irreversibles en el nervio óptico.
El papel de la IA en el análisis de los campos visuales
La evaluación de los campos visuales, que es fundamental en el diagnóstico del glaucoma, también se ha beneficiado de los avances en inteligencia artificial. La perimetría automatizada es la prueba estándar para evaluar los campos visuales, y los algoritmos de IA pueden analizar los resultados de estas pruebas de manera más rápida y precisa que los métodos tradicionales. En lugar de depender de la interpretación manual de los resultados, los sistemas basados en IA pueden identificar patrones anormales en los campos visuales que son característicos del glaucoma.
Además, la IA puede predecir la progresión de la enfermedad a través del análisis longitudinal de los cambios en los campos visuales de los pacientes. Esta capacidad predictiva es crucial para el manejo de la enfermedad, ya que permite a los médicos planificar intervenciones más efectivas y personalizadas para cada paciente.
Perspectivas futuras de la IA en el diagnóstico del glaucoma
El futuro de la inteligencia artificial en el diagnóstico del glaucoma es prometedor. A medida que los algoritmos se vuelvan más sofisticados y se disponga de mayores cantidades de datos, se espera que la precisión de los diagnósticos mejore aún más. Además, la combinación de IA con tecnologías emergentes, como la biometría ocular avanzada y los dispositivos de monitorización en tiempo real, podría transformar el diagnóstico del glaucoma.
La IA también tiene el potencial de personalizar el tratamiento para cada paciente, al analizar su historial médico, características individuales y respuestas al tratamiento. Esto no solo optimiza el manejo de la enfermedad, sino que también podría ayudar a reducir los efectos secundarios y mejorar los resultados a largo plazo.
En resumen, la inteligencia artificial está jugando un papel cada vez más importante en la detección y diagnóstico del glaucoma. Si bien todavía existen desafíos, como la necesidad de grandes bases de datos representativas y la superación de barreras en la aceptación clínica, los avances actuales demuestran el enorme potencial de la IA para transformar el cuidado de los pacientes con glaucoma. Con la continua evolución de esta tecnología, es probable que la IA se convierta en una herramienta esencial para mejorar el diagnóstico, personalizar los tratamientos y optimizar el manejo de esta enfermedad ocular.
Glaucoma y Miopía: Desafíos Diagnósticos y Estrategias de Evaluación
El diagnóstico del glaucoma en pacientes miopes presenta desafíos únicos debido a las alteraciones estructurales del ojo causadas por la elongación axial. En condiciones normales, las fibras nerviosas de la retina siguen un patrón organizado hacia el nervio óptico, pero en ojos miopes, el alargamiento ocular modifica esta disposición y afecta la morfología del disco óptico. Estas alteraciones pueden dificultar la interpretación de pruebas como la tomografía de coherencia óptica (OCT) y hacer que signos de miopía avanzada se confundan con daño glaucomatoso, lo que complica la detección temprana de la enfermedad.
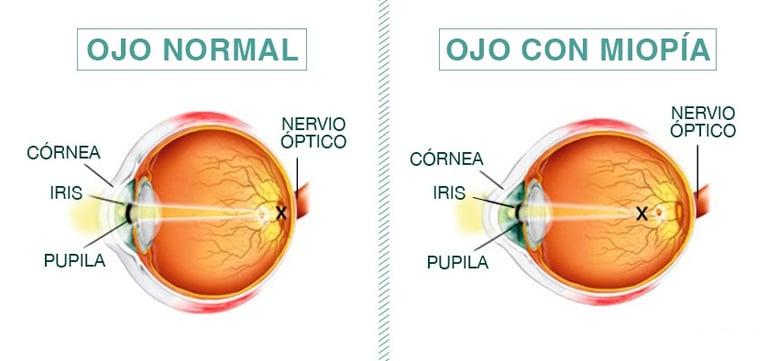
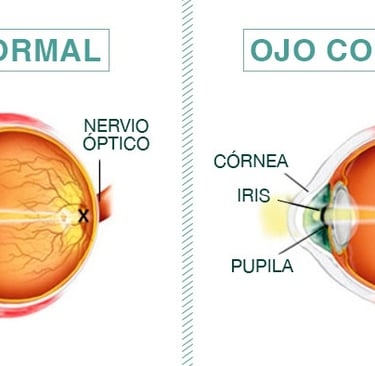
Imagen: centrodeojosbanfield.com
Uno de los principales cambios en ojos miopes es el adelgazamiento de la capa de fibras nerviosas de la retina (CFNR), un marcador clave en el diagnóstico del glaucoma. Sin embargo, en pacientes con miopía, este adelgazamiento puede deberse a la elongación ocular y no necesariamente a la pérdida de células ganglionares causada por el glaucoma. La magnificación ocular que ocurre en ojos con alta miopía puede alterar las mediciones de la OCT, lo que requiere ajustes en la interpretación de los resultados para evitar diagnósticos erróneos.
El análisis del anillo neuroretiniano (NRR) se ha propuesto como una alternativa más confiable para la detección del glaucoma en pacientes miopes. Este anillo rodea la excavación central del nervio óptico y su grosor mínimo (MRW) ha demostrado ser un indicador sensible de daño glaucomatoso. No obstante, en casos de miopía alta, el desplazamiento de la membrana de Bruch (BMO) puede afectar la precisión de estas mediciones, por lo que es fundamental considerar estos factores en la evaluación clínica.
La mácula, que contiene la mayor concentración de células ganglionares de la retina, representa otra herramienta valiosa para la detección del glaucoma en ojos miopes. A diferencia de la CFNR, la capa ganglionar-interna (GCIPL) en la mácula es menos afectada por la elongación axial y, por lo tanto, puede proporcionar mediciones más confiables. Estudios con OCT han demostrado que la evaluación de esta región, especialmente en el sector inferotemporal, mejora la precisión del diagnóstico y permite diferenciar entre cambios relacionados con la miopía y el daño glaucomatoso.
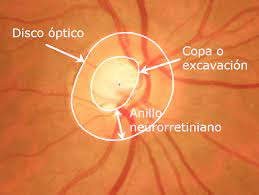
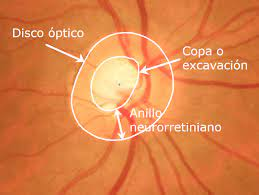
Imagen: Universidad Politécnica de Cartagena
Para mejorar la detección del glaucoma en pacientes miopes, es esencial combinar múltiples estrategias diagnósticas. El uso de tecnologías avanzadas como el OCT de barrido fuente (swept-source OCT), la evaluación de la atrofia peripapilar y el monitoreo a largo plazo de los cambios estructurales del ojo son claves para un diagnóstico más preciso. La personalización de los criterios diagnósticos y la correlación entre diferentes parámetros pueden ayudar a diferenciar entre las alteraciones propias de la miopía y los signos tempranos de glaucoma, optimizando el manejo de la enfermedad en esta población.
Diagnóstico Genético del Glaucoma
El diagnóstico genético del glaucoma se ha convertido en un área de creciente interés dentro de la oftalmología, debido a la compleja naturaleza genética de la enfermedad. A medida que avanzan las investigaciones, se ha reconocido que el glaucoma no es una enfermedad única, sino un grupo de trastornos relacionados por su manifestación clínica común: la neuropatía del nervio óptico y la pérdida de visión progresiva. El glaucoma está asociado a factores genéticos que varían entre los individuos, y el diagnóstico genético se está integrando cada vez más en la práctica clínica para ayudar a predecir el riesgo de desarrollar la enfermedad y para ofrecer opciones terapéuticas personalizadas
Genética y Nuevas Tecnologías en el Diagnóstico del Glaucoma
El glaucoma es una enfermedad con una fuerte base genética, ya que múltiples genes pueden influir en su desarrollo y progresión. Sin embargo, no solo la herencia juega un papel clave, sino también factores ambientales y mecanismos epigenéticos que pueden modificar la expresión de ciertos genes. Comprender estos aspectos permite mejorar el diagnóstico y diseñar tratamientos más personalizados. En los últimos años, la investigación genética ha avanzado considerablemente, utilizando modelos in vitro e in vivo, como organoides retinianos y sistemas de microfluidos, que ayudan a replicar los efectos de las mutaciones en las células del nervio óptico.
La relación entre genética y severidad del glaucoma es compleja. Aunque ciertos genes pueden aumentar el riesgo de desarrollar la enfermedad, otros factores, como la interacción con el ambiente y con otros genes, pueden influir en su progresión. Además, los mecanismos epigenéticos, como la metilación del ADN y la modificación de histonas, afectan la función de los genes relacionados con la muerte celular en la retina. Otro factor importante es el estrés oxidativo, un proceso en el que las células acumulan sustancias tóxicas que dañan su estructura. Esto afecta especialmente a las células ganglionares de la retina, lo que contribuye a la degeneración del nervio óptico.
Las alteraciones en el funcionamiento de las mitocondrias, que son responsables de generar energía en las células, también han sido vinculadas con el glaucoma. En enfermedades hereditarias como la neuropatía óptica de Leber y la atrofia óptica dominante, las mutaciones en genes mitocondriales pueden acelerar el daño al nervio óptico. Para estudiar estas mutaciones y su impacto, los investigadores han recurrido a la edición genética con la tecnología CRISPR/Cas9, que permite modificar el ADN con gran precisión. Esta herramienta no solo ayuda a entender mejor las causas genéticas del glaucoma, sino que también abre la puerta a posibles terapias que corrijan mutaciones responsables de la enfermedad.
CRISPR/Cas9 puede utilizarse de diferentes maneras en la investigación del glaucoma. Un enfoque es la reparación de genes defectuosos mediante cortes en el ADN, que permiten corregir mutaciones específicas. También existen métodos sin cortes, como la edición de bases, que permiten modificar la información genética sin dañar la estructura del ADN, reduciendo el riesgo de errores. Además, CRISPR puede ser utilizado para regular la actividad de ciertos genes, aumentando la expresión de genes protectores o disminuyendo la de aquellos que favorecen la neurodegeneración.
Estos avances en genética y biotecnología están revolucionando el diagnóstico y tratamiento del glaucoma. Aunque aún existen desafíos, como mejorar la entrega de terapias génicas al ojo, el desarrollo de modelos de enfermedades hereditarias y el uso de células madre inducidas (iPSCs) están ayudando a comprender mejor la enfermedad. Los estudios de asociación genética han identificado biomarcadores que pueden predecir el riesgo de desarrollar glaucoma, lo que podría facilitar un diagnóstico temprano y tratamientos personalizados. A medida que la genética y la biotecnología sigan evolucionando, la posibilidad de desarrollar terapias más eficaces y adaptadas a cada paciente será cada vez más cercana.
Glaucoma Congénito y Juvenil
El glaucoma congénito primario (GCP) es una forma de glaucoma que aparece en los primeros tres años de vida y es una de las principales causas de ceguera infantil. Dependiendo de la edad de inicio, se clasifica en:
Neonatal: desde el nacimiento hasta el primer mes.
Infantil: entre 1 y 24 meses.
Tardío: después de los 2 años.
Si se desarrolla entre los 3 años y la pubertad, se denomina glaucoma juvenil.
La incidencia del GCP varía según la población, con una frecuencia estimada de 1 en 18,000 nacimientos en personas de origen caucásico. Sin embargo, es más frecuente en poblaciones con alta consanguinidad, como en Arabia Saudita.
Los síntomas incluyen lagrimeo, frotamiento constante de los ojos y sensibilidad a la luz, mientras que los signos más característicos son ojos agrandados, edema corneal y estrías en la membrana de Descemet (líneas de Haab). Para confirmar el diagnóstico, es necesario medir la presión intraocular (PIO), evaluar el nervio óptico en busca de signos de daño y realizar una gonioscopía, que puede revelar anomalías en el drenaje del humor acuoso, como una estructura anormal del trabéculo o la inserción anómala del iris.
El GCP es causado por un desarrollo incompleto del trabéculo, la estructura responsable de drenar el humor acuoso. En el 60% de los casos, la enfermedad aparece de forma espontánea, sin antecedentes familiares, pero en el 40% restante se asocia con mutaciones en genes específicos.
Se han identificado cuatro regiones genéticas relacionadas con el GCP, todas heredadas de forma recesiva con penetrancia incompleta:
GLC3A: contiene el gen CYP1B1, el más comúnmente implicado en el GCP. También se ha asociado con otros trastornos como el glaucoma de ángulo abierto, la aniridia y el síndrome de Axenfeld-Rieger. CYP1B1 codifica una enzima involucrada en el desarrollo del trabéculo.
GLC3D: contiene el gen LTBP2, cuya alteración es una causa poco frecuente de GCP. Este gen codifica una proteína de la matriz extracelular que participa en la adhesión celular y la formación de fibras elásticas.
GLC3B y GLC3C: aún no se han identificado genes específicos responsables del GCP en estas regiones.
Además, en algunos pacientes con GCP, se han encontrado mutaciones en el gen TEK, que codifica una proteína clave para la formación del canal de Schlemm, una estructura esencial en el drenaje del humor acuoso. A diferencia de otros genes, las variantes en TEK se heredan de manera dominante, pero con una expresión variable.
Glaucoma Asociado a Defectos del Desarrollo
Algunas formas de glaucoma infantil están relacionadas con mutaciones en genes que afectan la formación del ojo durante el desarrollo embrionario.
· Síndrome de Axenfeld-Rieger: Se debe a mutaciones en los genes PITX2 y FOXC1, que regulan la migración de las células de la cresta neural. Se hereda de manera dominante y presenta una alta penetrancia, aunque con expresión variable.
Las anomalías oculares incluyen alteraciones del iris y el trabéculo, hipoplasia ocular y presencia de una línea anómala en la córnea (embriotoxón posterior). Aproximadamente el 50% de los pacientes desarrollan glaucoma.
Los rasgos sistémicos incluyen hipoplasia del maxilar, anomalías dentales y defectos cardíacos como comunicación interauricular.
· Aniridia congénita: Se produce por mutaciones en el gen PAX6, esencial en la formación del ojo. Esta enfermedad puede heredarse de manera dominante o presentarse de forma esporádica.
Los pacientes tienen restos de tejido del iris que pueden obstruir el drenaje del humor acuoso, aumentando la PIO.
Otras complicaciones incluyen hipoplasia foveal, opacificación corneal y cataratas.
En algunos casos, las alteraciones en PAX6 pueden estar asociadas con el síndrome de WAGR, una condición genética que también incluye tumor de Wilms, anomalías genitourinarias y discapacidad intelectual, debido a deleciones cercanas al gen WT1, un supresor tumoral.
Glaucoma Primario de Ángulo Abierto (GPAA)
El glaucoma primario de ángulo abierto (GPAA) es la forma más frecuente de glaucoma y afecta aproximadamente al 1.6% de las personas mayores de 40 años. Se caracteriza por daño progresivo en el nervio óptico sin una causa secundaria identificable.
Los principales factores de riesgo incluyen:
Edad avanzada
Antecedentes familiares
Presión intraocular elevada (aunque también puede ocurrir con PIO normal)
El GPAA tiene una base genética compleja, con al menos 15 genes involucrados en su desarrollo. Sin embargo, las variaciones genéticas por sí solas no explican completamente la enfermedad, ya que también intervienen factores ambientales y epigenéticos.
En el 95% de los casos, el GPAA se debe a la interacción de múltiples genes con otros factores de riesgo. Sin embargo, en el 5% de los casos, la enfermedad es causada por una mutación en un solo gen, con herencia dominante. Los genes más importantes en este grupo son:
MYOC (miocilina): Su mutación provoca la acumulación de proteínas anormales en el trabéculo, aumentando la resistencia al drenaje del humor acuoso y elevando la PIO.
OPTN (optineurina): Relacionado con el GPAA de tensión normal. Su alteración afecta la regulación de la inflamación y la autofagia, lo que puede provocar daño a las células del nervio óptico.
TBK1 (TANK-binding kinase 1): Su duplicación puede activar procesos inflamatorios y alterar la eliminación de desechos celulares en el nervio óptico.
Otros genes implicados en la regulación de la presión ocular, la supervivencia de las fibras nerviosas y la respuesta al tratamiento incluyen:
CAV1/CAV2: Regulan la salida del humor acuoso a través del trabéculo.
TMCO1: Mantiene el equilibrio del calcio intracelular y protege contra el estrés del retículo endoplasmático.
SIX1/SIX6: Factores de transcripción esenciales para el desarrollo del nervio óptico.
FOXC1: Relacionado con el síndrome de Axenfeld-Rieger y también con el GPAA.
CYP1B1: Principal gen del GCP, pero también involucrado en algunos casos de GPAA.
ANGPT1: Regula la estabilidad vascular del nervio óptico.
NTF4: Codifica un factor neurotrófico que protege las células ganglionares de la retina.
ASB10: Participa en la eliminación de proteínas en el trabéculo, afectando la salida del humor acuoso.
CDKN2A/CDKN2B: Regulan el ciclo celular y la apoptosis, influyendo en la degeneración del nervio óptico.
WDR36: Su alteración puede afectar la función y supervivencia de las células ganglionares.
Glaucoma Primario de Ángulo Cerrado (PACG)
El glaucoma primario de ángulo cerrado (PACG) es una de las principales causas de ceguera irreversible a nivel mundial, particularmente en poblaciones asiáticas. A diferencia del glaucoma primario de ángulo abierto (POAG), donde el drenaje del humor acuoso se bloquea de manera gradual, el PACG ocurre cuando el ángulo de la cámara anterior del ojo se cierra repentinamente. Este cierre impide el drenaje adecuado del humor acuoso, lo que provoca un aumento rápido de la presión intraocular (PIO), un factor crucial en el desarrollo de daños oculares irreversibles. El PACG es una enfermedad compleja que involucra tanto factores anatómicos como genéticos.
Los estudios han identificado varios genes asociados con el PACG, siendo el NNO1 (nanophthalmos 1) el principal causante directo en algunos casos. Este gen está relacionado con el nanoftalmos (ojos anormalmente pequeños) y la hipermetropía severa, condiciones que alteran la estructura ocular y pueden predisponer al cierre del ángulo. Otros genes como COL11A1, que influye en la formación de colágeno tipo XI, también contribuyen al riesgo de PACG, ya que afectan la configuración del ojo, haciendo que la cámara anterior sea más pequeña y favoreciendo el cierre del ángulo. Además, genes como MMP9 y PLEKHA7 están relacionados con la rigidez de las estructuras oculares y la estabilidad del ángulo, lo que incrementa la probabilidad de que se cierre.
Aunque estos genes desempeñan un papel clave en la predisposición genética al PACG, no todas las mutaciones explican completamente la enfermedad. La sola presencia de variantes genéticas no es suficiente para que se desarrolle el PACG, ya que otros factores, como las características anatómicas del ojo y los factores ambientales, también influyen. A pesar de los avances en la comprensión de la genética del PACG, aún queda mucho por descubrir sobre cómo estos factores interactúan para determinar la aparición de la enfermedad.
Glaucoma Pseudoexfoliativo (PEXG)
El glaucoma pseudoexfoliativo (PEXG) es una forma secundaria de glaucoma de ángulo abierto, que se caracteriza por la acumulación de material extracelular fibrilar en varias estructuras del ojo. Esta acumulación afecta principalmente al cristalino, pero también puede depositarse en el trabéculo, la cápsula del cristalino y la malla trabecular. A medida que el material se acumula, obstruye el flujo normal del humor acuoso, lo que aumenta la presión intraocular y causa daño al nervio óptico, lo que puede llevar a la pérdida de visión irreversible si no se trata adecuadamente.
La enfermedad comienza en una fase temprana conocida como síndrome de pseudoexfoliación (PEXS), donde el material anómalo se deposita en las estructuras oculares, principalmente en el cristalino. Sin embargo, solo algunos individuos con PEXS desarrollan glaucoma, lo que sugiere que factores adicionales influyen en la progresión de la enfermedad. A pesar de los avances en la investigación genética, aún hay aspectos de la enfermedad que no están completamente entendidos, como por qué esta afección afecta de manera asimétrica a los ojos y por qué se presenta en una edad avanzada.
Se ha identificado que ciertos genes juegan un papel importante en el desarrollo del PEXG. El gen LOXL1 (Lysyl oxidase-like 1) es uno de los más relevantes, ya que está implicado en la formación de fibras elásticas en la matriz extracelular. Variantes en este gen aumentan el riesgo de desarrollar PEXG al desestabilizar la matriz, favoreciendo la acumulación del material que causa la enfermedad. Otros genes, como CLU (Clusterina), CACNA1A y algunos relacionados con la remodelación tisular, también se han relacionado con el riesgo de la enfermedad. Además, factores ambientales y epigenéticos, como la exposición al sol y el estrés oxidativo, parecen contribuir a la aparición y progresión del PEXG.
Del Colirio a la Terapia Génica: Avances en el Tratamiento del Glaucoma
El glaucoma es una enfermedad ocular crónica que daña el nervio óptico, lo que puede llevar a la pérdida de visión irreversible si no se trata adecuadamente. El tratamiento del glaucoma tiene como objetivo principal frenar el progreso de la enfermedad y preservar la calidad de vida de los pacientes. La presión intraocular (PIO) elevada es uno de los principales factores que contribuyen al daño del nervio óptico, por lo que reducirla es la base del tratamiento. Sin embargo, es fundamental reconocer que la pérdida de calidad de vida en los pacientes con glaucoma puede comenzar de manera más temprana de lo que generalmente se cree. Por lo tanto, un diagnóstico temprano y un tratamiento adecuado son cruciales para evitar daños graves.
Actualmente, existen varias estrategias terapéuticas para tratar el glaucoma, y la elección del tratamiento depende de la gravedad y el tipo de glaucoma, así como de la respuesta individual del paciente. Los tratamientos se enfocan en reducir la presión intraocular y prevenir la progresión de la enfermedad, y pueden incluir opciones farmacológicas, láser y quirúrgicas.
Tratamiento Farmacológico: Medicamentos para Reducir la Presión Intraocular
Los medicamentos son la forma más común de tratar el glaucoma. El objetivo principal de los fármacos es reducir la presión intraocular, lo cual puede lograrse a través de diferentes mecanismos, como aumentar el drenaje del humor acuoso o disminuir su producción.
· Análogos de Prostaglandinas: Estos medicamentos son de primera línea para tratar el glaucoma. Funcionan al mejorar el drenaje del humor acuoso a través de la vía uveoescleral. Se administran una vez al día y tienen pocos efectos secundarios sistémicos. Sin embargo, pueden provocar efectos locales como enrojecimiento ocular, alargamiento de las pestañas y pigmentación en la piel alrededor de los ojos.
· Betabloqueantes, Agonistas Alfa-2, Inhibidores de la Anhidrasa Carbónica y Agonistas de la Rho Quinasa: Estos medicamentos tienen diversos mecanismos de acción y también se utilizan para controlar la PIO. Se administran generalmente en forma de gotas oftálmicas y pueden tener efectos secundarios que varían según el fármaco y el paciente.
Aunque los medicamentos pueden ser eficaces para reducir la PIO, es importante considerar que algunos pacientes pueden experimentar efectos secundarios o problemas con la adherencia al tratamiento, lo que requiere ajustes en el enfoque terapéutico.
Tratamientos con Láser
En los casos donde los medicamentos no son suficientes para controlar la presión ocular o cuando los pacientes no responden adecuadamente a los fármacos, se puede recurrir a procedimientos láser.
· Trabeculoplastia Selectiva con Láser (SLT): Es un tratamiento no invasivo que se utiliza principalmente en el glaucoma de ángulo abierto y la hipertensión ocular. Este procedimiento mejora el drenaje del humor acuoso al aplicar energía láser en el trabeculado, la estructura que regula la presión intraocular. Aunque generalmente es seguro, pueden presentarse efectos secundarios como hipema (sangrado en el ojo) o deformidad pupilar.
· Trabeculoplastia con Láser y Cirugía de Glaucoma: En ciertos casos, el tratamiento con láser puede no ser suficiente, y se puede considerar la cirugía como una opción. La trabeculectomía y los dispositivos de drenaje, que crean un nuevo canal para el drenaje del humor acuoso, son tratamientos quirúrgicos comunes. Si bien son efectivos, estos procedimientos tienen riesgos asociados, como infecciones o complicaciones derivadas de una presión ocular demasiado baja.
Tratamientos Quirúrgicos
La cirugía se reserva generalmente para los casos más avanzados de glaucoma o cuando los tratamientos médicos y con láser no logran controlar la presión intraocular. En estos casos, se pueden realizar diversas intervenciones:
· Trabeculectomía: Implica la eliminación de una parte del trabeculado o tejido corneoscleral para crear una nueva vía de drenaje para el humor acuoso. Este procedimiento puede ser eficaz, pero requiere un seguimiento estrecho, ya que puede haber complicaciones, como infecciones o una presión ocular excesivamente baja.
· Implantes de Drenaje: Se utilizan en algunos casos donde la trabeculectomía no tiene éxito o no es adecuada. Estos dispositivos proporcionan una forma alternativa de drenaje y son una opción en pacientes con un alto riesgo de complicaciones.
Lentes Terapéuticas para Glaucoma: Tipos, Avances y Retos en su Aplicación
El glaucoma es una enfermedad ocular que puede dañar el nervio óptico, generalmente debido a un aumento en la presión intraocular. Para tratar esta afección, se han investigado diversos métodos de administración de medicamentos, y uno de los enfoques más innovadores son las lentes de contacto cargadas con fármacos. Estas lentes ofrecen una forma efectiva de administrar el tratamiento directamente en el ojo, mejorando la biodisponibilidad y reduciendo la necesidad de aplicaciones frecuentes. A continuación, se presentan diferentes tipos de lentes de contacto cargadas con fármacos y sus ventajas, limitaciones y perspectivas de futuro.
Las lentes de contacto cargadas con fármacos representan una estrategia novedosa para la liberación controlada y continua de medicamentos directamente en el ojo. Estas lentes están diseñadas para mejorar la eficacia del tratamiento al mantener el medicamento en contacto constante con los tejidos oculares, lo que puede reducir las frecuencias de administración y mejorar la adherencia del paciente al tratamiento. Al estar en contacto cercano con la superficie ocular, las lentes aseguran que el fármaco actúe de manera directa sobre las áreas que lo necesitan, previniendo la eliminación rápida del mismo.
Tipos de Lentes de Contacto cargadas con Fármacos
Las lentes de contacto con nanopartículas, como liposomas o micelas, representan una innovación significativa en el tratamiento ocular. Estas lentes cargan fármacos dentro de pequeñas partículas microscópicas, lo que permite una liberación controlada y precisa del medicamento. Gracias a esta liberación controlada, la biodisponibilidad del fármaco mejora, lo que significa que más medicamento llega al área necesaria del ojo, reduciendo así la cantidad que se pierde. Además, al disminuir la cantidad de medicamento que se dispersa por el resto del cuerpo, se logran menores efectos secundarios y se incrementa la eficacia terapéutica, lo que convierte a estas lentes en una opción prometedora para tratar enfermedades como el glaucoma.
Otro tipo de lentes que ha mostrado avances son aquellas que incorporan vitamina E. Estas lentes actúan como una barrera física que ayuda a liberar el medicamento de manera más gradual. La vitamina E puede ser incorporada en la solución del medicamento o absorbida por las lentes antes de la aplicación, prolongando la liberación del fármaco en el ojo durante un período más largo. Este mecanismo de liberación controlada permite que el tratamiento sea más eficaz al mantener niveles constantes de medicamento en el ojo durante un tiempo prolongado, lo que puede mejorar los resultados terapéuticos y facilitar el cumplimiento del tratamiento.
Las lentes termo-sensibles son otra innovación destacada en el campo de las lentes de contacto para el tratamiento ocular. Estas lentes están diseñadas con materiales que responden a cambios de temperatura, lo que les permite liberar el medicamento de manera controlada cuando la temperatura de la superficie ocular alcanza un nivel específico. A temperaturas más bajas, las lentes retienen el fármaco, y al aumentar la temperatura ocular, liberan el medicamento de forma precisa. Este tipo de lentes es útil porque la liberación del medicamento solo ocurre bajo condiciones fisiológicas normales, lo que garantiza que el fármaco se libere en el momento y lugar adecuados.
El óxido de grafeno es un material avanzado que también se está utilizando en el desarrollo de lentes de contacto para el tratamiento del glaucoma. Gracias a su estructura única, el óxido de grafeno mejora la capacidad de las lentes para cargar y entregar medicamentos, especialmente aquellos que son difíciles de disolver en agua, como el bimatoprost. Este compuesto, utilizado en el tratamiento del glaucoma, se mejora en su absorción debido a las propiedades del óxido de grafeno, lo que aumenta la eficacia del tratamiento. Este tipo de lentes puede ser especialmente útil para mejorar la entrega de medicamentos en pacientes que necesitan tratamientos más eficaces y específicos.
Las lentes sensibles al pH son una innovación que aprovecha los cambios en el entorno ocular para liberar medicamentos de manera precisa. En el caso del glaucoma, el pH ocular puede cambiar en respuesta a la enfermedad, lo que facilita la liberación del medicamento cuando se detectan esos cambios en el entorno. Los fármacos están unidos a las lentes mediante enlaces sensibles al pH, que responden a las variaciones en la acidez o alcalinidad del ojo. Este enfoque asegura que el medicamento se libere solo en las condiciones adecuadas, mejorando la precisión del tratamiento y minimizando los riesgos de liberación prematura.
Finalmente, algunas lentes de contacto contienen potenciadores de permeabilidad, sustancias que mejoran la capacidad de la córnea para absorber el medicamento. Estos potenciadores, como los ácidos grasos, aumentan la biodisponibilidad del fármaco, lo que significa que una mayor cantidad del medicamento llega a las áreas necesarias del ojo. Al mejorar la absorción a través de la córnea, se asegura que el medicamento sea más eficaz y llegue directamente a las zonas que requieren tratamiento, lo que mejora el manejo de enfermedades oculares como el glaucoma.
Estabilidad y Solubilidad de Fármacos en Lentes de Contacto: Retos en su Almacenaje y Aplicación
Uno de los mayores retos es la incorporación de medicamentos que son poco solubles en agua, como los análogos de prostaglandinas, que suelen ser hidrofóbicos. Estos medicamentos son difíciles de cargar en lentes de contacto que, por lo general, deben ser hidrofílicas para garantizar la comodidad del paciente.
Es fundamental que las lentes de contacto cargadas con medicamentos mantengan su estabilidad tanto física como química. El medicamento debe conservar su integridad y las lentes deben mantener sus propiedades, como la permeabilidad al oxígeno y la resistencia mecánica, para garantizar un rendimiento adecuado durante su uso.
Desafíos y Limitaciones
A pesar de sus beneficios potenciales, las lentes de contacto cargadas con fármacos enfrentan varios desafíos que dificultan su aplicación generalizada en la práctica clínica.
Mantener una liberación constante y precisa del fármaco sigue siendo un desafío importante. Algunas lentes no logran mantener concentraciones terapéuticas efectivas durante el tiempo necesario, lo que puede limitar su eficacia. Esto supone un desafío, para que las lentes sean capaces de liberar el medicamento de manera continua y controlada según las necesidades fisiológicas del ojo, lo que requiere un control preciso de la liberación en función de factores como la presión intraocular.
¿Qué pasa con la Terapia Génica y Celular?
La terapia génica es una técnica emergente en la medicina que tiene el potencial de revolucionar el tratamiento de diversas enfermedades, incluido el glaucoma. Esta técnica se basa en la modificación del material genético de las células del ojo para corregir defectos que causan o agravan la enfermedad. Al introducir, alterar o reemplazar genes en las células oculares, la terapia génica busca restaurar el funcionamiento normal de estas células, reduciendo así los daños que provoca el glaucoma. Este enfoque ha demostrado ser prometedor, ya que no solo se centra en tratar los síntomas, sino que también puede abordar las causas subyacentes de la enfermedad.
Uno de los elementos clave en la terapia génica para el glaucoma son los vectores virales. Estos vectores son virus modificados que funcionan como vehículos para transportar el material genético a las células del ojo. Los virus adenoasociados (AAV) son particularmente útiles en la terapia ocular debido a su baja toxicidad y baja capacidad de causar respuestas inmunológicas adversas. Además, estos vectores no pueden replicarse en las células del huésped, lo que los hace más seguros para su uso en humanos. En estudios preclínicos, los vectores AAV han mostrado una capacidad notable para entregar genes a la retina, una de las áreas clave afectadas por el glaucoma.
Una de las principales metas en el tratamiento del glaucoma es reducir la presión intraocular (PIO), ya que su elevación es uno de los principales factores que contribuyen a la degeneración del nervio óptico. En este contexto, la terapia génica busca influir en las células responsables de regular la PIO, como las células del trabeculado, que son las encargadas de drenar el líquido ocular. Sin embargo, introducir genes en estas células ha demostrado ser más complejo que en la retina, debido a la dificultad para alcanzar la localización precisa en el trabeculado. A pesar de este desafío, los vectores virales, como los de adenovirus y AAV auto-complementarios, han mostrado una eficacia superior en la transducción de estas células, lo que podría llevar a un tratamiento más efectivo para reducir la PIO a largo plazo.
La protección de las células ganglionares de la retina (RGC), que son las principales responsables de la transmisión de señales visuales al cerebro, es otro objetivo crucial en el tratamiento del glaucoma. Estas células son especialmente vulnerables al daño por el aumento de la PIO y otros factores de riesgo, lo que puede conducir a la pérdida irreversible de visión. La terapia génica ha mostrado resultados prometedores al promover la protección y regeneración de las RGCs. A través de la sobreexpresión de genes protectores como el SIRT1 y el NMNAT2, y la mejora de la función mitocondrial de estas células, la terapia génica puede prevenir el daño neuronal y mejorar la supervivencia de las RGCs frente al estrés causado por el glaucoma.
Aunque las células ganglionares son las más afectadas en el glaucoma, las células no neuronales también juegan un papel importante en la patología de la enfermedad. Las células gliales, como los astrocitos, la microglía y las células de Müller, están involucradas en la respuesta inflamatoria y la homeostasis ocular. En el glaucoma, estas células pueden contribuir al daño neuronal si se activan en exceso. La terapia génica dirigida a estas células no neuronales podría restaurar su función protectora, reduciendo el daño provocado por la inflamación y favoreciendo un ambiente ocular saludable. Por ejemplo, las células de Müller pueden ayudar a eliminar el exceso de glutamato, una sustancia tóxica para las RGCs, y liberar factores neurotróficos que protegen a las células ganglionares.
En los últimos años, se han producido avances significativos en las técnicas de terapia génica para el glaucoma. Uno de los desarrollos más emocionantes es el uso de la tecnología CRISPR-Cas9, una herramienta de edición genética de alta precisión. Esta tecnología permite modificar genes específicos de manera exacta, abriendo nuevas posibilidades para tratar las mutaciones que causan o agravan el glaucoma. Además, los avances en el uso de nanopartículas y hidrogeles para la entrega de fármacos a las células oculares también han mostrado un gran potencial para mejorar la efectividad de la terapia génica. La terapia de reemplazo celular, que busca sustituir las células ganglionares dañadas por células sanas, también está en desarrollo y ha mostrado resultados prometedores en modelos preclínicos.
Conclusiones
El glaucoma es una enfermedad ocular compleja y progresiva que, si no se trata a tiempo, puede llevar a la pérdida irreversible de la visión. Debido a su carácter asintomático en las primeras etapas, el diagnóstico temprano es fundamental para prevenir daños severos en el nervio óptico. Herramientas como la paquimetría y la inteligencia artificial (IA) están revolucionando la detección del glaucoma, permitiendo evaluaciones más precisas y facilitando la identificación de personas con mayor riesgo. Sin embargo, aún existen desafíos en la integración de estas tecnologías en la práctica clínica, lo que requiere la recopilación de datos más representativos y su validación en estudios a gran escala.
El diagnóstico del glaucoma también enfrenta dificultades en poblaciones específicas, como los pacientes con miopía, debido a las alteraciones estructurales del ojo que pueden enmascarar o imitar los signos de la enfermedad. No obstante, avances en la tomografía de coherencia óptica (OCT) y el desarrollo de estrategias diagnósticas personalizadas han mejorado significativamente la precisión en la detección del glaucoma en estos casos. Adaptar las herramientas de diagnóstico a las características individuales de cada paciente y realizar un monitoreo a largo plazo son estrategias clave para un manejo más efectivo.
La investigación en genética ha abierto nuevas oportunidades para comprender mejor la predisposición al glaucoma y desarrollar enfoques terapéuticos más precisos. A medida que se identifican más variantes genéticas asociadas a la enfermedad, el uso de herramientas como CRISPR/Cas9 y las puntuaciones de riesgo poligénico permitirán avanzar hacia un diagnóstico más temprano y tratamientos personalizados. Estos descubrimientos también podrían ayudar a diseñar estrategias de prevención más eficaces para las personas con mayor riesgo genético.
En cuanto al tratamiento del glaucoma, la reducción de la presión intraocular sigue siendo el objetivo principal. La elección del enfoque terapéutico debe adaptarse a cada paciente, considerando la etapa de la enfermedad, la respuesta al tratamiento y su calidad de vida. Las opciones disponibles incluyen terapia farmacológica, procedimientos con láser y cirugía, cada una con sus beneficios y limitaciones. Un enfoque personalizado es esencial para mejorar los resultados y evitar la progresión de la enfermedad.
Entre las nuevas estrategias terapéuticas, las lentes de contacto cargadas con fármacos representan una alternativa prometedora, ya que permiten una liberación controlada y prolongada del medicamento. Este método podría mejorar la adherencia al tratamiento y optimizar la eficacia terapéutica. Aunque aún existen retos en su implementación, los avances en materiales y tecnologías biomédicas podrían hacer de estas lentes una opción viable en el futuro cercano.
La terapia génica también se perfila como una solución innovadora para abordar las causas subyacentes del glaucoma, en lugar de limitarse a controlar sus síntomas. La modificación del material genético de las células oculares podría ofrecer tratamientos más duraderos y efectivos. Sin embargo, para su aplicación clínica, será necesario continuar investigando para mejorar su seguridad, eficacia y accesibilidad.
En conclusión, el manejo del glaucoma está experimentando una transformación gracias a los avances en diagnóstico, genética y tratamientos innovadores. A medida que estas tecnologías continúan evolucionando, es posible que en el futuro se logren estrategias más eficaces y personalizadas que permitan no solo frenar la progresión de la enfermedad, sino también restaurar la función visual en los pacientes afectados. La combinación de enfoques tradicionales con nuevas terapias podría marcar un antes y un después en la lucha contra esta patología, mejorando la calidad de vida de millones de personas en todo el mundo.
Referencias:
Wang, Y., Yan, L., Qin, Y., & Fan, F. (2025). Research progress of corneal characteristics and changes in primary angle‑closure glaucoma (Review). Biomedical Reports, 22, 59
Liang Guo, Na Wang, Jing Chen, Rui Zhang, Dan Li, Lu Yang. (2025). Cellular senescence and glaucoma Experimental Gerontology. 202, 112718
Bhartiya, Shibal; Ichhpujani, Parul; Wadhwani, Meenakshi. (2025). Current perspectives in tackling glaucoma blindness. Indian Journal of Ophthalmology 73(Suppl 2):p S189-S196
Agbato D, Rickford K, Laroche D. (2025). Central Corneal Thickness and Glaucoma Risk: The Importance of Corneal Pachymetry in Screening Adults Over 50 and Glaucoma Suspects. Clin Ophthalmol. 19:563-570
Voykov, B; Prokosch, V; Lübke, J. (2025). Minimally Invasive Glaucoma Surgery. Dtsch Arztebl Int. 122: 23-30
Jin Y, Liang L, Li J, Xu K, Zhou W, Li Y. Artificial intelligence and glaucoma: a lucid and comprehensive review. (2024). Front Med (Lausanne). 11:1423813
Yong Woo Kim, Ki Ho Park. (2025). How to diagnose glaucoma in myopic eyes by detecting structural changes?. Asia-Pacific Journal of Ophthalmology. 14 (1): 100135
Qing Zhao, Linxin Wei, Youxin Chen. (2025). From bench to bedside: Developing CRISPR/Cas-based therapy for ocular diseases. Pharmacological Research. 213: 107638
D'Esposito F, Zeppieri M, Cordeiro MF, Capobianco M, Avitabile A, Gagliano G, Musa M, Barboni P, Gagliano C. (2024). Insights on the Genetic and Phenotypic Complexities of Optic Neuropathies. Genes (Basel).15(12):1559
Suva Roy. (2025). Emerging strategies targeting genes and cells in glaucoma. Vision Research. 227:108533
Suneel S, Kaliaperumal S, Kodidela S, Goud AC, Stephen M. (2024). Ocular Biometry and Genomic Association in Primary Angle Closure Disease. A Descriptive study. Rom J Ophthalmol.68(4):415-420
Diya Zhang, Cong Ren, Xuan Wang, Wenbo Cao, Mingkun Yu, Zihang Xu, Jia Li, Hongsheng Bi, Bin Guo. (2025). Treatment of glaucoma with drug-loaded contact lenses: A systematic review and meta-analysis. European Journal of Pharmacology. 995:177425
Hollitt GL, Hassall MM, Siggs OM, Craig JE, Souzeau E.(2025). Development and evaluation of patient-centred polygenic risk score reports for glaucoma screening. BMC Med Genomics. 18(1):21

(anuncios)