Lupus Eritematoso Sistémico: Manifestaciones Clínicas, Abordaje Diagnóstico y el Potencial de las células CAR-T
José Hernández Jiménez
5/6/202540 min leer



(publicidad)
¿Qué es el lupus eritematoso sistémico?
El lupus eritematoso sistémico es una enfermedad autoinmune crónica en la que el sistema inmunitario, que normalmente protege al cuerpo contra infecciones, ataca erróneamente los tejidos sanos. Esta condición puede afectar múltiples órganos, entre ellos la piel, las articulaciones, los riñones, el cerebro y el sistema cardiovascular. Al tratarse de una enfermedad compleja y variable, sus síntomas pueden ser muy distintos de una persona a otra.
¿A quién afecta con mayor frecuencia?
El lupus eritematoso sistémico es mucho más común en mujeres, especialmente entre los 15 y 44 años. De hecho, se estima que por cada hombre diagnosticado, hay hasta diez mujeres con la enfermedad. Aunque puede presentarse a cualquier edad, existen formas específicas, como el lupus de inicio tardío, que aparece después de los 50 años y suele manifestarse con síntomas distintos: menor afectación en la piel y los riñones, pero más frecuencia de inflamaciones como la pleuritis (en el revestimiento de los pulmones) y la pericarditis (en el revestimiento del corazón).
En cuanto a la distribución geográfica y étnica, el lupus eritematoso sistémico es más común en personas afroamericanas, hispanoamericanas, asiáticas americanas y afrocaribeñas, en comparación con personas blancas no hispanas. Estas poblaciones también suelen presentar formas más graves de la enfermedad.
¿Cuál es la causa de la enfermedad?
Aunque aún no se conoce una causa única, se ha identificado que una de las bases del lupus eritematoso sistémico es una deficiente eliminación de los residuos celulares. Esto provoca una activación anormal del sistema inmunitario y la producción de autoanticuerpos, que son proteínas que atacan las propias células del cuerpo. Estos autoanticuerpos forman complejos inmunes que se depositan en los tejidos, causando inflamación y daño progresivo.
Un aspecto central en este proceso es la activación de un tipo especial de células del sistema inmunológico llamadas células dendríticas plasmocitoides, las cuales liberan interferones tipo I, unas moléculas que intensifican la respuesta inmunitaria, empeorando la inflamación y la disfunción de órganos.
Impacto en la calidad de vida y el sistema de salud
El lupus eritematoso sistémico representa un desafío importante para los sistemas de salud debido a la necesidad de tratamientos prolongados, evaluaciones continuas y atención por parte de diversos especialistas médicos. En algunos países, como Polonia, la ausencia de guías clínicas adaptadas a los recursos locales complica el diagnóstico y el tratamiento oportuno.
La enfermedad suele cursar con períodos de remisión (sin síntomas) y recaídas (brotes de la enfermedad). En los casos más graves, puede llevar a fallo multiorgánico y poner en riesgo la vida del paciente.
Un vistazo a la historia del lupus eritematoso sistémico
La historia de esta enfermedad puede rastrearse hasta el año 400 antes de Cristo, y se ha dividido en tres grandes periodos: clásico, neoclásico y moderno.
En el periodo clásico, Hipócrates describió posibles úlceras asociadas a la enfermedad, refiriéndose a ellas como "herpes esthiomenos", aludiendo a un trastorno principalmente cutáneo.
Durante la etapa neoclásica, se reconocieron mejor sus manifestaciones clínicas. El médico Ferdinand Hebra describió el característico rash en forma de mariposa en el rostro, mientras que Jonathon Hutchison destacó la fotosensibilidad. En cuanto a los tratamientos, se comenzó a utilizar quinina, y más adelante, hormonas como la cortisona y la hidrocortisona.
En la era moderna, el descubrimiento de la célula LE en 1948, por Hargraves, marcó un avance clave en el diagnóstico. Más adelante, se desarrollaron métodos como la inmunofluorescencia, que permitió detectar anticuerpos antinucleares, esenciales para confirmar la enfermedad. Los estudios en modelos animales ayudaron a identificar factores genéticos implicados en el lupus, incluyendo su carácter familiar.
Gracias a estos avances, la expectativa de vida de las personas con lupus ha mejorado significativamente. Antes, la esperanza de vida tras el diagnóstico era inferior a cinco años; hoy, con el tratamiento adecuado, los pacientes pueden vivir durante décadas.
Variaciones en la incidencia y gravedad
La incidencia del lupus eritematoso sistémico varía entre 0.3 a 23.2 casos por cada 100,000 personas-año, dependiendo de la región geográfica. Las mujeres en edad fértil tienen entre 8 y 15 veces más probabilidades de desarrollarlo en comparación con los hombres. Además, hay importantes diferencias étnicas: las personas de origen africano, chino e hispano no solo tienen más riesgo de desarrollar la enfermedad, sino que también presentan formas más severas, como la nefritis lúpica, una inflamación grave de los riñones que eleva el riesgo de mortalidad.
Por otro lado, se ha observado que algunas poblaciones, como las de origen africano, responden peor a tratamientos con corticosteroides e inmunosupresores. En general, se estima que las personas con lupus tienen un riesgo de muerte 2.6 veces mayor que la población general. Entre los factores que más influyen en este desenlace están el diagnóstico tardío, la afectación renal, una alta actividad de la enfermedad, la aparición de infecciones y los eventos cardiovasculares graves.
(publicidad)
Una enfermedad en aumento
El incremento en la prevalencia del lupus eritematoso sistémico en las últimas décadas se atribuye a una mayor conciencia médica, mejoras en el diagnóstico temprano, y la existencia de registros internacionales que permiten conocer mejor la distribución y características de la enfermedad en diferentes regiones del mundo.
Patologías asociadas al lupus eritematoso sistémico
Alteraciones inmunológicas y daño multisistémico
Uno de los aspectos más relevantes del lupus eritematoso sistémico es la producción elevada y persistente de autoanticuerpos, entre los que se encuentran los anticuerpos antinucleares (ANA), anti-Sm, anti-ADN de doble cadena, antifosfolípidos y anti-β2-glicoproteína. Estos autoanticuerpos pueden estar presentes incluso varios años antes de que aparezcan los síntomas. Al unirse con antígenos, forman complejos inmunes que se acumulan en órganos como los riñones, la piel y el sistema nervioso central, provocando inflamación y daño local.
Los linfocitos B, al perder su tolerancia a los componentes del propio cuerpo, se convierten en productores de autoanticuerpos. Estas células, al madurar en plasmoblastos y células plasmáticas, generan anticuerpos de forma continua. También participan en la activación de los linfocitos T, iniciando una cascada de señales inmunológicas que amplifican la respuesta defensiva del organismo, pero de forma descontrolada.
Una pieza clave en esta activación exagerada es la acción de los interferones tipo I, un grupo de citocinas que conectan la inmunidad innata con la inmunidad adaptativa. Estos interferones se producen cuando el cuerpo detecta material genético anormal, a través de sensores como los receptores tipo Toll (TLR). La señal llega a través de rutas intracelulares como la JAK/STAT, lo que activa genes que refuerzan la actividad inmunológica.
Se ha observado que en aproximadamente la mitad de los pacientes con lupus eritematoso sistémico, los niveles de interferones tipo I están aumentados. Además, sus células muestran una sobreactivación de genes inducidos por estos interferones, lo que refleja una activación constante del sistema inmune y agrava la enfermedad. Esta activación sostenida es provocada por la detección crónica de ácidos nucleicos por receptores como TLR3, TLR7, TLR9, cGAS y RIG-I. Factores ambientales, como la radiación ultravioleta, intensifican este proceso.
Los interferones tipo I también estimulan la acción de células del sistema inmune como las células dendríticas, los linfocitos T y los linfocitos B, formando un ciclo de activación que produce más autoanticuerpos y agrava la inflamación. El equilibrio entre distintos tipos de linfocitos T CD4+ también está alterado. Se observan desequilibrios entre células Th1, Th2, Th17 y T reguladoras, cada una con funciones específicas mediante la producción de diferentes citocinas. Un exceso de citocinas como IFN-γ, IL-17 o TNF-α, junto con niveles bajos de IL-10 o TGF-β, contribuye a una respuesta inmune desregulada.
También tienen un papel importante las células T foliculares colaboradoras (Tfh) y las células T reguladoras foliculares (Tfr), que controlan la actividad de los linfocitos B. En muchos casos, se detecta una mayor actividad de células Th2 en comparación con las Th1, lo que favorece la producción de autoanticuerpos. Este desequilibrio es impulsado por citocinas como IL-4 y IL-12, y también puede estar influenciado por el metabolismo celular, que sugiere que cambios en la alimentación, como una dieta baja en carbohidratos, podrían ayudar a restablecer el equilibrio inmunológico.
Otra característica de la enfermedad es la incapacidad del cuerpo para eliminar adecuadamente los restos celulares y complejos inmunes, lo que perpetúa la inflamación. El sistema del complemento, que ayuda en esta limpieza, puede estar alterado. Tanto su exceso como su deficiencia pueden contribuir a la inflamación crónica. Además, células como los macrófagos pueden fallar en su función depurativa, exacerbando la respuesta autoinmune.
El lupus eritematoso sistémico también afecta al funcionamiento de la inmunidad innata, donde los neutrófilos tienen dificultades para eliminar células muertas y muestran un aumento del estrés oxidativo. Producen interferones tipo I de forma anómala y forman estructuras conocidas como trampas extracelulares de neutrófilos (NETs). Si estas no se eliminan correctamente, activan más el sistema inmune y aumentan la inflamación. Un subtipo de neutrófilos, los granulocitos de baja densidad, está relacionado con una forma más grave de la enfermedad.
En cuanto a las células dendríticas, su papel en la presentación de antígenos es crucial. Las células dendríticas plasmocitoides, en particular, son grandes productoras de interferones tipo I. Además, las células dendríticas foliculares ayudan a mantener los autoantígenos en los ganglios linfáticos, prolongando la activación del sistema inmune.
En muchos pacientes, se detecta una activación anormal y persistente de la vía del interferón tipo I, especialmente del interferón alfa y el interferón beta, lo que intensifica la inflamación crónica y el daño a los órganos. Algunas variantes genéticas pueden aumentar la sensibilidad de esta vía, incrementando el riesgo de desarrollar lupus eritematoso sistémico.
El depósito de complejos inmunes en tejidos como los riñones, la piel, las articulaciones y el sistema nervioso central es otra de las causas del daño inflamatorio. Estos depósitos desencadenan reacciones inmunes locales, generando síntomas como el clásico eritema en alas de mariposa sobre el rostro, fotosensibilidad y úlceras orales, que reflejan el carácter multisistémico de la enfermedad.
Manifestaciones cutáneas y factores locales
En el caso del lupus eritematoso cutáneo, los desencadenantes ambientales como la radiación ultravioleta, el tabaco, los pesticidas o ciertos medicamentos pueden provocar cambios epigenéticos que modifican la actividad de los genes relacionados con el sistema inmune. Aunque la mayoría de los estudios se han centrado en la forma sistémica, también se han encontrado alteraciones genéticas asociadas a la forma cutánea, en genes involucrados en la apoptosis, la presentación de antígenos, la producción de anticuerpos y la vía del interferón.
En las lesiones cutáneas, los queratinocitos afectados por el sol liberan citoquinas inflamatorias como IL-1, IL-6, TNF-α e interferones, lo que atrae a células inmunes como los linfocitos y las células dendríticas plasmocitoides. Estas últimas son escasas en piel sana, pero abundan en las lesiones. Además, los queratinocitos aumentan la producción de interferones tipo I y III, que intensifican la activación inmune.
La actividad de los linfocitos Th1, que liberan interferón gamma e interleucina 2, refuerza este proceso inflamatorio a través de vías intracelulares como JAK/STAT. Estas señales perpetúan un ciclo de inflamación en la piel. También se activan linfocitos T CD8+ y células NK, que emplean enzimas como granzima B para inducir la muerte celular, agravando el daño tisular.
En el lupus cutáneo crónico, los niveles de autoanticuerpos en la sangre suelen ser más bajos que en otras formas de la enfermedad, pero las inmunoglobulinas tienen un papel relevante en las lesiones de la piel. Por ejemplo, la IgM se deposita primero, seguida por el componente C3 y la IgG, que es clave en la formación de complejos inmunes.
Aunque se ha identificado un aumento de IL-17 en el suero y la piel de pacientes con lupus eritematoso sistémico, su función en el lupus cutáneo discoide es menos prominente. También se ha observado una reducción de linfocitos T reguladores en las zonas afectadas. Curiosamente, niveles más altos de linfocitos Th22 parecen estar relacionados con una mejor capacidad de reparación cutánea, lo que sugiere que la interleucina 22 podría ser útil como marcador de regeneración. La microbiota cutánea también muestra alteraciones, como un aumento de Staphylococcus y Corynebacterium, y una disminución de Cutibacterium, aunque su papel aún no se comprende completamente.
Diagnóstico
Manifestaciones Clínicas del Lupus Eritematoso Sistémico: Guía Diagnóstica y Descriptiva
Manifestaciones cutáneas
Las manifestaciones en la piel suelen ser señales importantes que ayudan en el diagnóstico del lupus eritematoso sistémico. Estas se agrupan principalmente en tres categorías:
Lupus cutáneo agudo: se presenta con erupción malar (en forma de mariposa sobre el rostro) o erupciones generalizadas tipo maculopapular.
Lupus cutáneo subagudo: se caracteriza por lesiones en anillos o similares a la psoriasis.
Lupus cutáneo crónico: incluye diversas formas como el lupus discoide, verrucoso, tumido, mucoso, paniculitis lúpica, y otras dermatitis parecidas al lichen plano.
Algunas de estas lesiones son poco específicas, pero siguen siendo relevantes. El lupus cutáneo subagudo es una manifestación independiente con una alta asociación al lupus sistémico. Por otro lado, el lupus cutáneo agudo es prácticamente exclusivo de esta enfermedad.
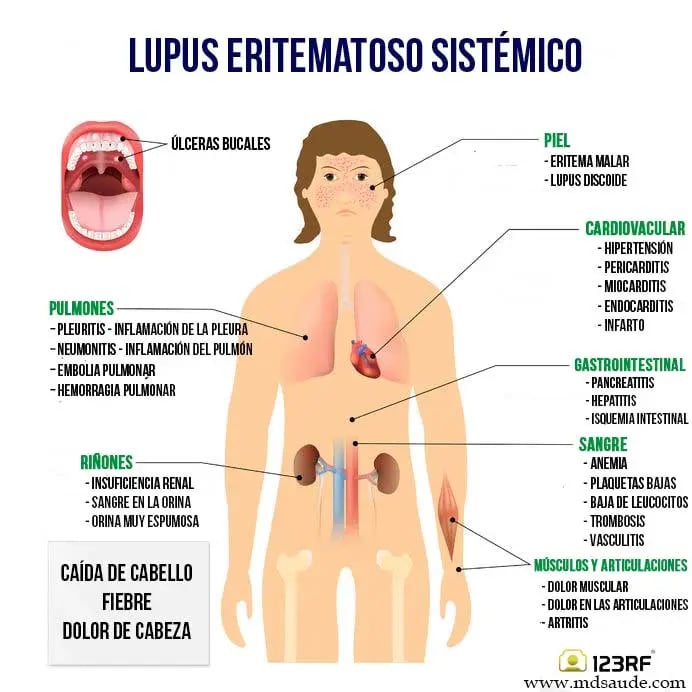
image: md.saude.com
Lesiones mucocutáneas y diagnóstico diferencial
El diagnóstico de lesiones mucocutáneas exige experiencia médica. Manifestaciones como alopecia no cicatricial y úlceras orales son comunes pero no específicas. A menudo se necesita una biopsia cutánea para confirmar el diagnóstico, especialmente si la presentación clínica es atípica.
Muchas lesiones cutáneas se agravan con la exposición solar, pero la fotosensibilidad fue excluida de los criterios recientes por su baja especificidad. La rosácea, por ejemplo, puede confundirse con lupus, aunque la ausencia de pústulas, telangiectasias y el aspecto plano de la erupción lúpica ayudan a diferenciarlas.
Principios diagnósticos y ponderación de síntomas
En los criterios diagnósticos más recientes, solo se considera la manifestación con mayor peso diagnóstico para evitar duplicaciones. Por ejemplo, tener anticuerpos antinucleares y lesiones cutáneas no es suficiente para diagnosticar lupus sin otras pruebas de afectación sistémica o autoanticuerpos específicos.
Afectación renal
La nefritis lúpica es una de las manifestaciones más específicas del lupus. Su diagnóstico requiere una combinación de biopsia renal compatible y presencia de autoanticuerpos, especialmente contra el ADN de doble cadena.
Las formas más graves, como la nefritis proliferativa (clase III y IV), son suficientes para clasificar la enfermedad.
La nefritis membranosa (clase V), en cambio, requiere apoyo diagnóstico adicional.
Manifestaciones articulares y musculoesqueléticas
La artritis en el lupus afecta articulaciones sin erosión ósea pero puede causar deformidades (como en el síndrome de Jaccoud). Se define clínicamente por sinovitis en al menos dos articulaciones con rigidez matutina.
La miositis lúpica, aunque infrecuente, se manifiesta por elevación de enzimas musculares como la creatinina fosfocinasa. Síntomas más generales como artralgias y mialgias son comunes pero poco específicos.
Manifestaciones serosas y respiratorias
Las serositis como la pleuritis y la pericarditis son comunes. La pericarditis aguda tiene un alto valor diagnóstico si se excluyen otras causas como infecciones o síndrome antifosfolípido. También puede presentarse peritonitis estéril, a veces con elevación inusual de proteína C reactiva.
Manifestaciones neuropsiquiátricas
Las más significativas son la psicosis y las convulsiones. Otras como la mielitis, neuropatías periféricas, o corea se consideraron previamente pero actualmente tienen menor peso. Es crucial descartar causas infecciosas o el síndrome antifosfolípido antes de atribuir estos síntomas al lupus.
Manifestaciones hematológicas
Las citopenias lúpicas incluyen:
Anemia hemolítica autoinmune, con prueba de Coombs positiva, aumento de reticulocitos y disminución de haptoglobina.
Trombocitopenia, que puede parecerse a la púrpura trombocitopénica idiopática.
Leucopenia, atribuible a medicamentos, infecciones u otras enfermedades hematológicas.
La linfopenia, aunque frecuente, no fue incluida por falta de especificidad.
Signos generales
La fiebre no infecciosa ha sido incorporada a los nuevos criterios como un signo temprano útil, siempre que se excluyan causas como infecciones bacterianas (sugeridas por elevación de proteína C reactiva). Puede acompañarse de fatiga, artralgias y mialgias, síntomas que también aparecen en enfermedades que simulan al lupus. La linfadenopatía puede requerir biopsia si se sospecha linfoma.
Otras manifestaciones sistémicas menos comunes
El lupus puede afectar múltiples órganos con síntomas que no siempre se consideran en los criterios formales, como:
Neumonitis lúpica
Enfermedad pulmonar intersticial
Hipertensión pulmonar
Endocarditis de Libman-Sacks
Hepatitis autoinmune
Pancreatitis
Vasculitis gastrointestinal
Estas deben considerarse solo tras excluir causas alternativas.
Biomarcadores y seguimiento renal
El análisis de orina es útil para monitorear el estado renal. Entre los biomarcadores clásicos se incluyen:
Proteinuria
Relación proteína/creatinina
Proteinuria en 24 horas
No siempre son concordantes, por lo que se estudian nuevos biomarcadores urinarios como citocinas, quimioquinas, moléculas de adhesión celular y factores de crecimiento. Algunos prometedores son la angiopoyetina-like 4, la L-selectina y el TGF-β1. Sin embargo, su utilidad puede verse afectada por la variabilidad diaria o por infecciones urinarias, lo que complica su aplicación clínica inmediata.
(publicidad)
Autoanticuerpos como Marcadores de Actividad y Daño en el Lupus Eritematoso Sistémico
El sistema inmunológico en las personas con lupus eritematoso sistémico ataca por error tejidos y órganos del propio cuerpo. Esto produce una respuesta inmunológica anormal que genera autoanticuerpos y complejos inmunes, los cuales pueden afectar a múltiples órganos. Con el tiempo, se ha observado que estas anomalías inmunológicas están presentes en casi todos los pacientes, lo que ha llevado a ajustar los criterios diagnósticos. Por ejemplo, en estudios clínicos con fármacos como belimumab, se ha comprobado que los beneficios solo se observan en personas con actividad inmunológica detectable, lo que justifica la inclusión de criterios inmunológicos obligatorios en el diagnóstico.
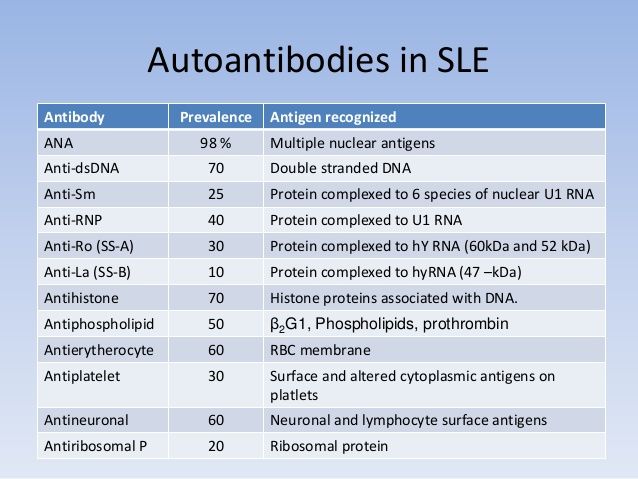

imagen: immunologuy: autoimmune disease
Anticuerpos antinucleares y otros autoanticuerpos
Uno de los análisis más comunes es el de los anticuerpos antinucleares (ANA). Estos se encuentran positivos en más del 97% de los pacientes con lupus en algún momento de su evolución. Sin embargo, debido a su baja especificidad, su presencia por sí sola no es suficiente para confirmar el diagnóstico. Por eso, el ANA se ha convertido en un criterio de entrada obligatorio, aunque su ausencia no lo descarta por completo.
Entre los autoanticuerpos más específicos del lupus se encuentran los dirigidos contra el ADN de doble cadena (anti-dsDNA) y contra proteínas como las histonas, que forman parte de los nucleosomas. También destaca el anti-Sm, exclusivo del lupus, aunque con baja sensibilidad. Otros anticuerpos como los anti-Ro, anti-La y anti-U1RNP no son exclusivos del lupus, pero pueden ayudar a identificar manifestaciones clínicas particulares.
Anticuerpos antifosfolípidos y síndrome antifosfolípido
Los anticuerpos antifosfolípidos (aPL) son relevantes sobre todo en pacientes que desarrollan síndrome antifosfolípido, ya que están asociados a trombosis y complicaciones del embarazo. En el lupus, un resultado positivo puede ser suficiente con una sola medición, a diferencia del síndrome antifosfolípido primario, que requiere confirmación.
Manifestaciones renales: nefritis lúpica
La nefritis lúpica es una manifestación frecuente. Se identifica por proteinuria o hallazgos en el sedimento urinario como cilindros celulares. Ante una proteinuria significativa, se recomienda una biopsia renal. No obstante, otras condiciones como linfomas pueden causar hallazgos similares, lo que puede llevar a errores diagnósticos si no se realiza una evaluación completa.
Afectación articular
La artritis lúpica es frecuente y constituye un criterio diagnóstico importante. Se caracteriza por la ausencia de erosión articular y de anticuerpos anti-CCP, diferenciándola de la artritis reumatoide. Cuando ambas enfermedades coinciden, se utiliza el término "rhupus".
Afectación neurológica
Las manifestaciones neurológicas incluyen desde cefaleas hasta psicosis, vinculadas con anticuerpos como los anti-ribosoma P y anti-NMDAR. Estas lesiones suelen ser más frecuentes que la vasculitis y pueden confundirse con enfermedades vasculares. El síndrome antifosfolípido secundario también puede afectar al sistema nervioso. Biomarcadores como anti-U1RNP, anti-RibP, interleucinas, TNF-alfa e interferones en el líquido cefalorraquídeo ayudan a diferenciar tipos de neurolupus.
Manifestaciones cutáneas
En la piel, se ha relacionado el receptor de hidrocarburos arilo (AhR) en células Th17 y Treg con una mayor actividad inflamatoria. Los anticuerpos anti-SSA se asocian al lupus cutáneo subagudo, y la sobreexpresión del gen vestigial-like family member 3 favorece una respuesta inflamatoria localizada.
Afectación cardiovascular
El lupus incrementa el riesgo de aterosclerosis precoz y eventos cardiovasculares. Biomarcadores como la lipoproteína de alta densidad disfuncional, la troponina T ultrasensible y la relación entre glóbulos blancos y colesterol HDL permiten evaluar el riesgo. También son útiles los anticuerpos contra la paraoxonasa 1, la lipoproteína de alta densidad, la E-selectina y las anticardiolipina IgG.
Evolución de los criterios de clasificación
Los criterios diagnósticos han evolucionado con el tiempo. Inicialmente definidos por el American College of Rheumatology, se han actualizado varias veces. En 2012, se incorporaron los criterios del grupo SLICC, que exigen al menos un criterio inmunológico. En 2019, la Alianza Europea de Asociaciones de Reumatología y el ACR propusieron un nuevo sistema basado en ANA positivos y un esquema de puntuación por dominios clínicos e inmunológicos, lo que ha mejorado la sensibilidad y especificidad.
Técnicas de detección y sensibilidad de los ANA
La prueba de ANA mediante inmunofluorescencia indirecta (IIF) en células HEp-2 es el método más utilizado. Un título igual o mayor a 1:80 se considera positivo. Esta técnica tiene alta sensibilidad, pero baja especificidad, ya que los ANA también se encuentran en personas sanas. Además de IIF, se emplea ELISA, que presenta ventajas y limitaciones propias. La interpretación adecuada requiere conocimiento técnico de los métodos utilizados.
Anticuerpos antinucleosoma
Los anticuerpos antinucleosoma (ANuA) tienen una prevalencia alta en pacientes con lupus y se asocian a la nefritis y la actividad de la enfermedad. Su sensibilidad es del 61% y su especificidad del 94%, lo que los convierte en una herramienta útil para apoyar el diagnóstico, incluso en formas inducidas por fármacos.
Evaluación del Complemento como Herramienta Diagnóstica en el Lupus Eritematoso Sistémico
El lupus eritematoso sistémico es una enfermedad en la que el sistema inmunológico produce complejos inmunes que pueden activar el sistema del complemento, una parte del sistema inmune que ayuda a eliminar microorganismos y células dañinas. Esta activación del complemento puede llevar a una disminución de ciertas proteínas en la sangre, en especial cuando no hay problemas en la producción de proteínas, como ocurre en enfermedades del hígado. Aunque estos depósitos de complejos inmunes no son exclusivos del lupus eritematoso sistémico, la medición de los niveles de las proteínas C3 y C4 en la sangre es una herramienta útil para hacer seguimiento de la enfermedad. Una disminución en ambas suele indicar actividad de la enfermedad relacionada con los complejos inmunes.
Además, se sabe que algunas personas nacen con una deficiencia genética de C4, lo cual puede aumentar el riesgo de desarrollar lupus eritematoso sistémico. Por esta razón, los niveles bajos del complemento (C3, C4 o CH50) han sido incluidos en los criterios diagnósticos más recientes de esta enfermedad. En estos criterios, encontrar tanto C3 como C4 bajos tiene mayor relevancia que si solo uno de ellos está reducido. Aunque ya no se utiliza de forma rutinaria en todos los lugares, la prueba del complemento hemolítico total (CH50) y otras pruebas más complejas para detectar productos del complemento en otras células sanguíneas, como los glóbulos rojos, podrían tener un valor adicional en el diagnóstico, aunque todavía no están estandarizadas en todo el mundo.
La activación del complemento por los complejos inmunes puede medirse de forma indirecta mediante los niveles de C3 y C4 en el suero, que se usan para evaluar tanto la presencia de estos complejos como la actividad de la enfermedad. Estos niveles bajos se consideran biomarcadores inmunológicos incluidos en los criterios de clasificación del lupus desde 2012. En la versión más reciente de 2019, tener bajos tanto C3 como C4 se considera más relevante que tener solo uno de los dos reducido, lo cual facilita el diagnóstico. Además, cuando estos niveles bajos se acompañan de un resultado positivo en la prueba de anticuerpos antinucleares (ANA), se logra una especificidad diagnóstica del 94.3 %. Esta especificidad aumenta hasta el 97.6 % si ambos componentes del complemento (C3 y C4) están disminuidos junto con un ANA positivo.
También se ha observado que una disminución de C3 y C4 puede anticipar un brote clínico de la enfermedad y está relacionada con un aumento de su actividad, especialmente cuando hay complicaciones en los riñones o en la sangre. Sin embargo, como los niveles bajos de C3 y C4 por sí solos no son exclusivos del lupus eritematoso sistémico, su valor como biomarcadores es limitado si no se interpretan junto con otros signos y síntomas clínicos.
La deficiencia hereditaria de C1q también se ha relacionado fuertemente con esta enfermedad. Los anticuerpos anti-C1q pueden reducir los niveles de C1q y desempeñar un papel importante en el desarrollo de la nefritis lúpica, que es la inflamación de los riñones causada por el lupus. Estos anticuerpos pueden interferir con la eliminación de los complejos inmunes y las células muertas, o hacer que se acumulen en los riñones, causando daño. Se ha comprobado que niveles elevados de anticuerpos anti-C1q están relacionados con una mayor actividad de la enfermedad renal y pueden predecir crisis renales con buena sensibilidad y especificidad. Por otro lado, la ausencia de estos anticuerpos tiene un alto valor predictivo negativo, lo que significa que es muy poco probable que la persona desarrolle nefritis lúpica si no los tiene.
A pesar de su utilidad potencial, los anticuerpos anti-C1q todavía no se han incorporado en los criterios diagnósticos ni en la guía clínica para el tratamiento del lupus eritematoso sistémico, debido a que no existe una prueba de laboratorio estandarizada a nivel mundial. Es importante tener en cuenta que estos anticuerpos también pueden aparecer en otras enfermedades autoinmunes, como la urticaria vasculítica hipocomplementémica, el síndrome de Sjögren, la artritis reumatoide, el síndrome de Stevens-Johnson, e incluso en personas aparentemente sanas.
(publicidad)
Interferones, Proteínas y Células Inmunes: Herramientas Emergentes en el Monitoreo del Lupus
En los últimos años, ha crecido el interés por descubrir biomarcadores innovadores que ayuden a detectar y controlar mejor el lupus eritematoso sistémico. Esto se debe a la necesidad de contar con herramientas más precisas y menos invasivas que permitan un diagnóstico temprano, predecir brotes, evaluar los distintos tipos de manifestaciones clínicas, monitorear la actividad de la enfermedad y detectar la afectación de órganos específicos. Entre los avances más destacados, se encuentra la investigación en torno a la señalización del interferón tipo I (IFN) y sus efectos en el cuerpo.
Actividad de interferón tipo I en suero
Un estudio retrospectivo observó que la actividad del interferón tipo I en suero al inicio del tratamiento se relaciona con la actividad de la enfermedad en personas que aún no han recibido terapia. Esta actividad se asoció principalmente con fiebre, alteraciones en la sangre y manifestaciones en la piel y mucosas. Además, se comprobó que los niveles de interferón disminuyen conforme mejora la enfermedad, lo que sugiere que podría ser un biomarcador útil para evaluar el estado inicial de la enfermedad.
En una investigación realizada con pacientes hospitalizados por lupus en fase grave, se encontró que los niveles de interferón alfa (IFN-α) en sangre eran mejores predictores de mortalidad que otros indicadores más generales, como el índice de actividad de la enfermedad o los niveles de anticuerpos. Esto indica que el IFN-α podría ser un biomarcador valioso para casos graves, ayudando a tomar decisiones clínicas más ajustadas a cada paciente.
Proteína IFI44L
A través del análisis del ARN en células inmunes de pacientes y personas sanas, se identificó que la proteína IFI44L, inducida por el interferón, se encuentra en niveles elevados en quienes padecen lupus eritematoso sistémico. Este hallazgo sugiere que IFI44L podría ser un biomarcador prometedor para el diagnóstico, debido a su alta sensibilidad y especificidad.
Proteínas inducidas por interferón
En un amplio estudio, se detectaron niveles altos de diversas proteínas activadas por el interferón en pacientes con lupus, como BAFF, CCL8, CXCL10 y CXCL11, en comparación con personas sanas. Además, otras proteínas como CCL8, CXCL13 e IL-1RA fueron más elevadas en pacientes con lupus activo. Estas proteínas se correlacionaron con la actividad general de la enfermedad, lo que sugiere que pueden ser biomarcadores útiles para el seguimiento de la actividad del lupus.
Biomarcadores en nefritis lúpica
La nefritis lúpica es una complicación grave que afecta los riñones. Estudios recientes han identificado varios biomarcadores importantes en este contexto:
IFI16: Se encontró que una mayor presencia de esta proteína en el tejido renal se relaciona con una mayor actividad de la enfermedad y con un pronóstico más grave, lo que indica su potencial como biomarcador para predecir la respuesta al tratamiento renal.
VSIG4: Esta proteína mostró un alto potencial para diferenciar entre nefritis lúpica activa e inactiva y para distinguir a los pacientes de personas sanas. También se asoció con varios parámetros clínicos y patológicos de la enfermedad renal.
sTREM-1 en orina: En pacientes con lupus y afectación renal, se encontró que los niveles urinarios de esta molécula se correlacionan con la actividad de la enfermedad en el riñón, especialmente con la presencia de proteinuria y bajos niveles de ciertos componentes del sistema inmune. Esto sugiere que sTREM-1 podría ser un biomarcador útil para evaluar la actividad renal.
Inmunidad de las células Natural Killer (NK)
Las células Natural Killer (NK) forman parte del sistema inmunológico. En personas con lupus eritematoso sistémico se ha detectado un aumento en la proporción de células NK inmaduras en comparación con las células NK maduras. Este desequilibrio refleja una posible alteración en el equilibrio inmunológico y se relaciona con la actividad general de la enfermedad y con la afectación renal, lo que lo convierte en un posible biomarcador de actividad inmunológica.
Biomarcadores neuropsiquiátricos
El compromiso del sistema nervioso, conocido como lupus neuropsiquiátrico, es una de las manifestaciones más complejas de la enfermedad. Se han identificado algunas proteínas en el líquido cefalorraquídeo (LCR) que podrían ayudar a diagnosticar mejor este tipo de lupus.
Cinco proteínas con patrones únicos de expresión —KLK5, L-selectina, Trappin-2, TCN2 y CST6— han demostrado una alta precisión para diferenciar a los pacientes con afectación neuropsiquiátrica de aquellos sin esta complicación y de los individuos sanos.
Biomarcadores relacionados con la neuroinflamación
En pacientes con lupus que también presentan síntomas depresivos, se han encontrado niveles reducidos de marcadores de inflamación en el sistema nervioso dentro del líquido cefalorraquídeo. Esto sugiere que puede haber un mecanismo específico vinculado a la depresión en el lupus, destacando la importancia de contar con biomarcadores para detectar y tratar las complicaciones neuropsiquiátricas.
Tecnologías ómicas aplicadas al lupus eritematoso sistémico: hacia una medicina de precisión
Aplicaciones de los enfoques ómicos en el estudio del lupus eritematoso sistémico
Los enfoques ómicos han abierto nuevas posibilidades para comprender mejor el lupus eritematoso sistémico, permitiendo la identificación de biomarcadores más sensibles y específicos para seguir la evolución de la enfermedad. Estas tecnologías incluyen el análisis del transcriptoma, epigenoma, genoma y metaboloma, y se han aplicado en distintos tipos celulares, como células T, células B y células de sangre periférica. Por ejemplo, se ha observado un enriquecimiento significativo de factores de transcripción relacionados con la señalización del interferón tipo I, como STAT1 y STAT2, en todos estos tipos celulares. Además, estudios de transcriptómica de célula única han permitido distinguir las células inmunes de pacientes respecto a las de individuos sanos, mostrando niveles elevados de genes estimulados por interferón en subpoblaciones específicas como monocitos, células T, células asesinas naturales, células dendríticas y, de manera destacada, en células plasmáticas.
La investigación también ha revelado una fuerte firma genética en las células renales de pacientes con nefritis lúpica, incluyendo características de fibrosis e interferón en las células del túbulo renal, asociadas a una respuesta reducida al tratamiento. Asimismo, se ha encontrado una correlación notable entre los perfiles de expresión génica en células inmunes de la orina y del riñón, lo que sugiere que la orina podría ser una alternativa menos invasiva a la biopsia renal. Aunque los neutrófilos no han sido consistentes como biomarcadores, sus perfiles transcriptómicos han mostrado asociación con la progresión hacia nefritis activa. En paralelo, estudios epigenéticos han identificado alteraciones en las células B, influenciadas por factores ambientales, que contribuyen a la desregulación de la expresión génica. La metilación del gen IFI44L, por ejemplo, se presenta como un marcador diagnóstico de alta sensibilidad y especificidad.
Avances genéticos, metabolómicos y proteómicos en la caracterización de la enfermedad
Los estudios del genoma completo han permitido identificar múltiples loci genéticos relacionados con la susceptibilidad al lupus eritematoso sistémico. A partir de estos datos, se han calculado puntuaciones de riesgo poligénico que pueden predecir no solo la probabilidad de desarrollar la enfermedad, sino también el riesgo de daño orgánico, disfunción renal y mortalidad. Además, se ha demostrado que estas puntuaciones están asociadas con niveles de expresión génica en células B vírgenes y de memoria, y se ha confirmado que variantes del gen ITGAM aumentan el riesgo y gravedad de la enfermedad, especialmente en casos con nefritis lúpica. Este tipo de análisis genético representa una herramienta clave tanto para el diagnóstico temprano como para la estratificación del riesgo clínico.
Por otro lado, el metaboloma también ha demostrado ser una fuente valiosa de biomarcadores. Estudios realizados con muestras fecales han identificado compuestos como L-valina, pirimidina y erucamida como posibles indicadores diagnósticos del lupus eritematoso sistémico. Además, análisis proteómicos de tejido renal han identificado proteínas como coronina-1A y granzima B como marcadores de nefritis lúpica y de mal pronóstico. Sin embargo, uno de los principales desafíos en esta área es la variabilidad biológica, que puede afectar la precisión y reproducibilidad de los hallazgos. Para que los biomarcadores identificados lleguen a aplicarse en la práctica clínica, es esencial diseñar estudios rigurosos, con tamaños de muestra adecuados, parámetros bien definidos y análisis estadísticos sólidos que permitan validar los resultados obtenidos.
Exosomas como Biomarcadores y Terapia en el Lupus Eritematoso Sistémico
Los exosomas son pequeñas vesículas extracelulares que se liberan naturalmente por casi todas las células del cuerpo y desempeñan un papel fundamental en la comunicación celular, especialmente en el sistema inmunológico y en el desarrollo de enfermedades autoinmunes. Miden entre 40 y 160 nanómetros y están rodeados por una doble membrana lipídica que protege su contenido, el cual incluye proteínas, lípidos, ácidos nucleicos, aminoácidos y otros metabolitos. Su formación comienza con la invaginación de la membrana celular, generando endosomas tempranos, que pueden fusionarse con otras vesículas internas para luego madurar a endosomas tardíos. En su interior se crean las llamadas vesículas intraluminales, que, tras clasificarse correctamente, se liberan como exosomas al fusionarse con la membrana celular, un proceso regulado por proteínas como Rab27a y Rab27b. La participación del complejo ESCRT es esencial para seleccionar adecuadamente las moléculas que se incorporarán a estas vesículas. Sin embargo, en el contexto de enfermedades autoinmunes como el lupus eritematoso sistémico, estos procesos pueden alterarse, dando lugar a exosomas con una composición anómala que puede contribuir a una activación inmunitaria inapropiada y al deterioro de los tejidos afectados.
Heterogeneidad y Especificidad de los Exosomas
Una de las características más destacadas de los exosomas es su heterogeneidad. Esta diversidad se debe a factores como el tipo celular de origen, la vía de formación y la naturaleza de los contenidos que transportan. Los receptores de superficie en la membrana de los exosomas son específicos, lo que permite una interacción dirigida con células receptoras particulares. Esta especificidad es crucial para su función en la comunicación intercelular y en la modulación de procesos fisiológicos. En enfermedades autoinmunes, esta heterogeneidad puede tener efectos tanto proinflamatorios como inmunomoduladores, dependiendo del contenido y del tipo de célula que los origina.
Contenido de los Exosomas y su Relevancia Funcional
Los exosomas contienen principalmente ARN (especialmente microARN), lípidos, proteínas, y otras moléculas pequeñas. Los microARN (miARN) dentro de los exosomas actúan como reguladores de la expresión génica, mientras que los lípidos como la esfingomielina o el colesterol son esenciales para facilitar la fusión con otras membranas y asegurar la estabilidad estructural. Estas moléculas no solo protegen el contenido del exosoma, sino que también son clave para su capacidad de ser absorbido por otras células, modificando su comportamiento y funciones, particularmente en contextos donde el sistema inmune está comprometido.
Papel Inmunológico y Patológico de los Exosomas
Los exosomas funcionan como mensajeros intercelulares y están implicados en procesos como la inflamación, la proliferación celular, la regulación genética y la reparación tisular. En enfermedades autoinmunes como el lupus eritematoso sistémico, se ha demostrado que los exosomas secretados por ciertos tipos celulares, como los fibroblastos sinoviales, pueden modificar la función de otras células, como los osteoblastos, ayudando a reparar el daño óseo. También han mostrado un papel importante en la angiogénesis y en la regulación de la función endotelial, aspectos críticos en enfermedades inflamatorias crónicas.
Diagnóstico y Perspectivas futuras como Terapia
Los exosomas están demostrando ser una herramienta prometedora para el diagnóstico temprano y el seguimiento no invasivo de enfermedades como el lupus eritematoso sistémico, especialmente en casos de nefritis lúpica. A diferencia de la biopsia renal, que es un procedimiento invasivo, los exosomas obtenidos del suero o la orina permiten una evaluación menos invasiva y más dinámica de la actividad de la enfermedad. Se ha identificado que ciertos miARNs, como el miR-21, miR-155 y miR-451a, están elevados en pacientes con lupus, lo que se correlaciona con el daño renal, mientras que el miR-146a se encuentra en niveles reducidos. Además, los exosomas derivados de células madre mesenquimatosas tienen propiedades inmunomoduladoras, lo que permite regular las subpoblaciones celulares como las Th17 y Treg, reducir la inflamación y mejorar la eliminación de células dañadas. Asimismo, moléculas como el miR-181d-5p en exosomas derivados de macrófagos podrían ser reguladas para controlar la inflamación en la nefritis lúpica. Procesos como la senescencia celular y genes como ALOX5, PTGER2 y PRKCB podrían actuar como biomarcadores clave para entender mejor esta enfermedad y desarrollar terapias más efectivas.
(publicidad)
Tratamientos
Nuevos objetivos de tratamiento
En el último año, nuevos avances en la comprensión de la patogénesis del lupus eritematoso sistémico (LES) han ofrecido nuevos objetivos para el tratamiento, explorando moléculas y tecnologías tanto en modelos animales como en ensayos clínicos de fase 1.
Estudios preclínicos y de fase I
Los receptores tipo Toll (TLR) 7 y 8 son componentes clave del sistema inmunológico innato, y su activación persistente se ha vinculado con el desarrollo del lupus eritematoso sistémico. Un compuesto experimental llamado E6742, que actúa como antagonista dual de estos receptores, fue evaluado en modelos de ratón con esta enfermedad. Los resultados mostraron que E6742, administrado incluso después de que la enfermedad había comenzado, logró reducir la producción de autoanticuerpos y prevenir el daño a órganos, lo cual es un avance importante. Posteriormente, en un ensayo clínico de fase I con personas sanas, este fármaco demostró ser seguro y bien tolerado, además de lograr una disminución de citoquinas inflamatorias en sangre en función de la dosis. Si bien estos resultados son alentadores, aún se requieren estudios en pacientes con lupus eritematoso sistémico para confirmar su eficacia clínica.
Otro objetivo terapéutico prometedor es la cinasa de tirosina del bazo (Syk), una enzima involucrada en la activación de células inmunes. Su actividad anormal se ha asociado con esta enfermedad, y un inhibidor selectivo llamado Cevidoplenib mostró efectos beneficiosos en ratones al reducir los niveles de anticuerpos tipo IgG, la inflamación renal y la pérdida de proteínas por orina. Asimismo, el fármaco Rozibafusp alfa, que actúa bloqueando simultáneamente las moléculas ICOSL y BAFF, demostró mayor eficacia en estudios preclínicos que los enfoques que bloquean solo una de estas rutas. En un ensayo en humanos, se observó que su comportamiento en el cuerpo variaba según la dosis, lo cual sugiere una buena interacción con sus objetivos. Aunque estas terapias presentan nuevas oportunidades para el tratamiento, también deben enfrentarse a desafíos como la optimización de la dosificación, el monitoreo de efectos adversos y la validación en estudios clínicos a mayor escala.
Ensayos clínicos de fase II y III
Deucravacitinib es un inhibidor selectivo de TYK2, una enzima implicada en la señalización de citoquinas que desempeñan un papel importante en el desarrollo del lupus eritematoso sistémico. En un estudio clínico en fase II, este medicamento demostró su capacidad para disminuir la actividad de la enfermedad en personas con lupus activo, mostrando mejores resultados que el placebo. Sin embargo, se registraron algunos efectos secundarios, como infecciones y problemas en la piel. Por otro lado, otra estrategia terapéutica prometedora consiste en la inhibición de BLyS y APRIL, moléculas responsables de estimular la producción de autoanticuerpos. En este contexto, telitacicept, una proteína de fusión diseñada para bloquear dichas moléculas, mostró resultados alentadores en un ensayo clínico en fase 2b. Los pacientes que recibieron este tratamiento experimentaron una mejora clínica significativa, y el fármaco fue, en general, bien tolerado.
Tratamiento con Belimumab
Belimumab es un anticuerpo monoclonal que actúa bloqueando la proteína BAFF (también conocida como BLyS), esencial en la supervivencia y activación de las células B, responsables de producir autoanticuerpos en el lupus eritematoso sistémico. Su incorporación al tratamiento estándar ha mostrado beneficios importantes, especialmente en pacientes con nefritis lúpica, una complicación renal grave de la enfermedad. Estudios recientes han evidenciado que belimumab puede mejorar la función renal, reducir la actividad general del lupus y permitir una disminución en el uso de esteroides orales, lo que contribuye a un mejor control de la enfermedad y una mejor calidad de vida. En poblaciones asiáticas, también se ha observado una respuesta positiva al tratamiento, lo que apoya su utilidad en diversos grupos étnicos.
Sin embargo, los ensayos clínicos han indicado que belimumab no ofrece una protección clara frente a los síntomas neuropsiquiátricos del lupus, lo que señala áreas aún pendientes de investigación. Fue el primer tratamiento biológico aprobado por la Administración de Alimentos y Medicamentos (FDA) en 2011 para adultos con lupus eritematoso sistémico de moderada a grave. Posteriormente, se autorizó su uso en formato subcutáneo en 2017 y en pacientes pediátricos entre 5 y 17 años en 2019, tras demostrar seguridad y eficacia en estos grupos. Además, un ensayo clínico de fase III confirmó su efectividad en el tratamiento de la nefritis lúpica, consolidando su papel en la protección de la función renal y la reducción del daño orgánico a largo plazo.
Tratamiento con Anifrolumab
Anifrolumab es un anticuerpo monoclonal completamente humano de tipo inmunoglobulina G1 que actúa inhibiendo la señalización del receptor de interferón tipo I, una molécula implicada en la inflamación del lupus eritematoso sistémico. Este fármaco fue aprobado en 2021 por la FDA para el tratamiento del lupus eritematoso sistémico moderado a grave, en combinación con terapias estándar. Se administra por vía intravenosa a una dosis de 300 mg cada cuatro semanas. Los estudios clínicos MUSE y TULIP demostraron que anifrolumab mejora significativamente la respuesta al tratamiento, particularmente en la reducción de síntomas como la inflamación y las lesiones cutáneas, además de disminuir la necesidad de glucocorticoides, lo que favorece una mejor calidad de vida y menos efectos secundarios relacionados con estos medicamentos.
La eficacia de anifrolumab también se ha evidenciado en pacientes con nefritis lúpica, donde mostró mejoras en los resultados renales sin comprometer el perfil de seguridad. Además, se observó una mayor respuesta terapéutica en personas con un perfil genético caracterizado por alta actividad de interferón tipo I, lo que sugiere un enfoque más personalizado en el tratamiento. Entre los beneficios observados se incluyen una reducción en la actividad general de la enfermedad, menor tasa de recaídas y mejoras en manifestaciones cutáneas y musculoesqueléticas. En conjunto, estos hallazgos respaldan el uso de anifrolumab como una opción eficaz y segura para el tratamiento del lupus eritematoso sistémico.
Tratamiento con Voclosporin
Voclosporina es un inhibidor de la calcineurina que fue aprobado en 2021 para el tratamiento de la nefritis lúpica activa en combinación con otros tratamientos inmunosupresores. Este fármaco se presenta en forma de tabletas orales y pertenece a la misma clase de medicamentos que el tacrolimus y la ciclosporina, que también inhiben la calcineurina para regular la respuesta inmunitaria. En ensayos clínicos, voclosporina ha demostrado ser eficaz para mejorar los resultados renales, reducir la proteinuria (presencia de proteínas en la orina) y disminuir la necesidad de tratamiento con esteroides, lo que puede reducir los efectos secundarios asociados con estos medicamentos.
Los estudios realizados hasta la fecha han confirmado la seguridad y eficacia de voclosporina en diversas poblaciones de pacientes con lupus eritematoso sistémico. En investigaciones controladas, se observó que la combinación de voclosporina con micofenolato mofetil (un inmunosupresor) y esteroides proporcionó una mejora significativa en la función renal en comparación con los pacientes que solo recibían los dos tratamientos convencionales. Además, los datos preliminares de un estudio de extensión a dos años sugieren que voclosporina ayuda a mantener la reducción de la proteinuria y la estabilidad de la función renal durante un periodo de hasta 30 meses, lo que refuerza su potencial como una opción terapéutica a largo plazo para los pacientes con esta complicación del lupus eritematoso sistémico.
Tratamiento con Rituximab
El rituximab, un anticuerpo monoclonal dirigido contra el CD20 y capaz de eliminar las células B, ha mostrado un fuerte potencial en el tratamiento del lupus eritematoso sistémico. Sin embargo, dos ensayos clínicos importantes no lograron cumplir con sus objetivos principales, posiblemente debido a un diseño de estudio inadecuado. En estos estudios, EXPLORER, centrado en casos de lupus moderado a severo, y LUNAR, enfocado en la nefritis lúpica, no alcanzaron los resultados esperados. A pesar de estos resultados negativos, un análisis posterior mostró ciertos efectos terapéuticos positivos, como mejoras en la proteinuria en el estudio LUNAR, y un beneficio clínico en subgrupos de afroamericanos e hispanos en el estudio EXPLORER. Una posible explicación para la falta de eficacia del rituximab en el tratamiento del lupus podría ser la eliminación insuficiente de las células B localizadas en los tejidos inflamados, ya que, aunque el fármaco elimina eficazmente las células B circulantes, estas persisten en los órganos afectados en pacientes con enfermedades autoinmunes como la artritis reumatoide o el síndrome de Sjögren. En modelos de lupus en ratones, la eliminación total de las células B mediante tratamientos con anticuerpos anti-CD19 ha inducido remisiones prolongadas, sugiriendo que la eliminación completa de las células B periféricas podría ser necesaria para una respuesta terapéutica efectiva. Este punto ha sido destacado en análisis posteriores del estudio LUNAR. Como resultado, se han propuesto nuevos anticuerpos anti-CD20, como el obinutuzumab, que es más eficaz en la eliminación de células B en comparación con el rituximab. Actualmente, el obinutuzumab se está evaluando en pacientes con nefritis lúpica y ha mostrado una mejora del 12.7% en la respuesta renal en comparación con el placebo, aunque se han presentado algunas complicaciones infecciosas durante su tratamiento. Por otro lado, el rituximab también ha mostrado mejoras en varios aspectos del lupus, aunque los resultados clínicos han sido mixtos. Este medicamento se utiliza principalmente en pacientes con lupus resistente a otros tratamientos o aquellos con enfermedades hematológicas asociadas a la enfermedad.
Nuevas Fronteras Terapéuticas en el Lupus Eritematoso Sistémico: De Células Plasmáticas a CAR-T
Células Plasmáticas de Larga Vida: Una Oportunidad en el Lupus Eritematoso Sistémico
Las células plasmáticas de larga vida, que son responsables de la producción de anticuerpos en la médula ósea, no expresan las moléculas CD19 y CD20, y no requieren de BAFF para su supervivencia a largo plazo, lo que las hace resistentes a las terapias actuales dirigidas a las células B. Este hallazgo sugiere que la depleción de células plasmáticas podría ser una estrategia terapéutica más eficaz en el tratamiento del lupus eritematoso sistémico. En este contexto, se están investigando varias estrategias, como la inhibición del proteasoma, que es esencial para la supervivencia de las células plasmáticas de larga vida. En modelos animales, el bortezomib, un inhibidor del proteasoma, redujo el número de células plasmáticas y prolongó la supervivencia en un modelo de ratón con lupus eritematoso sistémico. Sin embargo, en un pequeño ensayo clínico en humanos, se observó una alta tasa de interrupción del tratamiento debido a efectos secundarios graves y a un impacto mínimo en los niveles de anticuerpos anti-DNA de doble cadena. Es posible que una adaptación compensatoria de los componentes del proteasoma proteja a las células plasmáticas de la muerte, limitando significativamente el efecto terapéutico. Otros estudios han explorado experiencias de la onco-hematología en el tratamiento del mieloma múltiple. En este sentido, estudios piloto han demostrado que daratumumab, un anticuerpo monoclonal anti-CD38 que se expresa en las células plasmáticas, pudo inducir beneficios clínicos significativos en casos refractarios de lupus eritematoso sistémico. Sin embargo, dado que el CD38 también se expresa en otras células del sistema inmune que son cruciales para la defensa contra patógenos y la regulación inmunológica, se deben explorar estrategias alternativas para dirigirse a las células plasmáticas en el tratamiento del lupus eritematoso sistémico. En este ámbito, se están evaluando agentes terapéuticos potenciales como el elotuzumab, que se dirige al SLAMF7, una proteína expresada en las células plasmáticas tanto malignas como no malignas, así como en las células activadas DN2 y en las células circulantes que secretan anticuerpos.
Terapia con células CAR-T en lupus eritematoso sistémico: Un enfoque innovador
La inmunoterapia contra el cáncer ha mostrado avances significativos en los últimos años, especialmente con el uso de células T modificadas genéticamente. Este tratamiento, conocido como terapia con células CAR-T, se basa en la modificación de las células T del sistema inmunológico para que reconozcan y destruyan células específicas, como las células tumorales. La terapia con células CAR-T ha sido utilizada principalmente en el tratamiento de cánceres de células B como linfomas y leucemias, pero en los últimos tiempos se ha comenzado a explorar su potencial en el tratamiento de enfermedades autoinmunes como el lupus eritematoso sistémico. Este enfoque involucra la introducción de receptores de antígenos quiméricos en las células T, los cuales permiten que estas células se dirijan específicamente a células dañinas del organismo.
El tratamiento con células CAR-T se divide en dos componentes principales: una porción extracelular que identifica el objetivo (como los anticuerpos monoclonales) y una porción intracelular que activa la señalización dentro de las células T. Este sistema permite que las células T no solo reconozcan el antígeno específico, sino que también inicien una respuesta inmune eficaz para destruir las células objetivo. En el contexto de enfermedades autoinmunes como el lupus eritematoso sistémico, las células CAR-T están siendo investigadas como una terapia dirigida contra las células B autoreactivas, responsables de atacar componentes del propio organismo.
Recientemente, los estudios sobre el uso de células CAR-T en lupus eritematoso sistémico han mostrado resultados prometedores, especialmente en pacientes con formas refractarias de la enfermedad. La estrategia se basa en la manipulación de las células T para atacar las células B, que en el lupus eritematoso sistémico producen anticuerpos contra el propio ADN del cuerpo. En algunos ensayos, se ha demostrado que el tratamiento con células CAR-T dirigidas contra el antígeno CD19, presente en las células B, genera una rápida remisión de los síntomas y una reducción sostenida en los niveles de linfocitos B, sin efectos adversos graves.
Sin embargo, la terapia con células CAR-T no está exenta de riesgos. Uno de los efectos secundarios más graves es el síndrome de tormenta de citoquinas, una reacción inflamatoria severa que puede resultar en complicaciones como la disfunción de órganos. Aunque se pueden emplear anticuerpos monoclonales para bloquear ciertas citoquinas proinflamatorias como la IL-6, aún existen preocupaciones sobre la seguridad a largo plazo de este tratamiento. Además, la eliminación de células B podría aumentar la susceptibilidad a infecciones, ya que estas células son fundamentales en la protección contra patógenos.
El uso de células CAR-T también presenta otras consideraciones. Aunque algunos pacientes han experimentado remisión completa y duradera del lupus eritematoso sistémico sin necesidad de medicamentos adicionales, el tratamiento puede causar efectos secundarios como el síndrome de liberación de citocinas y la neurotoxicidad, que incluye síntomas como confusión o convulsiones. Además, la modificación genética de las células T mediante vectores virales puede desencadenar reacciones alérgicas o aumentar el riesgo de formar nuevos tumores, lo que plantea una preocupación sobre la inmunogenicidad de la terapia.
Una ventaja importante de las células CAR-T es que pueden fabricarse utilizando las células T del propio paciente (terapia autóloga), lo que reduce el riesgo de rechazo. Sin embargo, este proceso de fabricación es relativamente lento, lo que puede ser un inconveniente en pacientes gravemente enfermos. Para abordar este desafío, se han desarrollado protocolos de producción rápida que permiten reducir el tiempo necesario para producir las células CAR-T. Esta mejora podría ser crucial para que los pacientes reciban el tratamiento a tiempo, especialmente en aquellos con formas más graves de la enfermedad.
Algunas investigaciones también están explorando el uso de células CAR-T modificadas para atacar tanto células B como células plasmáticas de larga vida, responsables de la producción de anticuerpos patológicos en el lupus eritematoso sistémico. Los estudios han mostrado que este enfoque combinado podría ser efectivo no solo para tratar los síntomas del lupus eritematoso sistémico, sino también para prevenir las complicaciones asociadas con la nefritis lúpica, una forma de la enfermedad que afecta los riñones. Los resultados preliminares sugieren que los pacientes que reciben esta terapia pueden alcanzar una remisión completa y sostenida.
Finalmente, a pesar de los riesgos asociados, la terapia con células CAR-T ofrece una esperanza significativa para aquellos pacientes con lupus eritematoso sistémico que no responden a tratamientos convencionales. Aunque se necesita más investigación para comprender completamente la eficacia y seguridad a largo plazo de esta terapia, su capacidad para inducir una remisión duradera sugiere que podría convertirse en una opción terapéutica revolucionaria para el tratamiento de enfermedades autoinmunes. A medida que se desarrollen tecnologías para mejorar la producción de células CAR-T y se exploren enfoques más precisos, este tratamiento podría representar una solución definitiva para muchos pacientes.
Otras terapias prometedoras
Se han realizado varios intentos para mejorar la función de las células T reguladoras en el lupus eritematoso sistémico debido a sus propiedades inmunosupresoras, mostrando resultados prometedores mediante la transferencia adoptiva de células T reguladoras policlonales. También se ha considerado como estrategia terapéutica la posibilidad de dirigir anticuerpos específicos contra las células dendríticas plasmocitoides (pDCs), dado el papel crítico que estas células desempeñan en el desarrollo de la enfermedad. Otra opción terapéutica es la administración de células mesenquimatosas alogénicas con propiedades inmunorreguladoras, que han mostrado potencial en estudios preclínicos. Además, se ha observado que la inhibición de la peptidil arginina deiminasa 4 (PAD4), una enzima clave en la formación de redes extracelulares de neutrófilos, tiene un efecto positivo en modelos experimentales de nefritis. La inhibición de quinasas asociadas a varios receptores de moléculas proinflamatorias, como JAK1 y TYK2, también ha mostrado resultados favorables, y actualmente se están llevando a cabo ensayos clínicos para evaluar su eficacia. Otros estudios están explorando estrategias para aumentar la actividad inmunosupresora de las células T reguladoras, como su activación mediante la administración de IL-2 a dosis bajas. Estas son algunas de las terapias innovadoras que aún se encuentran en investigación para el tratamiento futuro del lupus eritematoso sistémico.
(Publicidad)
Referencias
Ceasovschih, A., Alexa, R.-E., Șorodoc, V., Asaftei, A., Stoian, D. C., Morărașu, B. C., Balta, A., Lionte, C., Stoica, A., Sîrbu, O., Constantin, M., Diaconu, A.-D., Lăcătușu, C.-M., Grigorescu, E.-D., & Șorodoc, L. (2025). Systemic Lupus Erythematosus Features in Elderly Patients: Case-Based Review. Journal of Clinical Medicine, 14(8), 2558.
Makowska J, Kwiatkowska B, Krajewska-Włodarczyk M, Batko B, Stajszczyk M, Świerkot J, Żuber Z, Leszczyński P, Sebastian A, Władysiuk M, Walecka I, Chmielewski M, Stasiołek M, Maślińska M; as the Working Group. Protocol for the development of Polish clinical guidelines for the management of patients with systemic lupus erythematosus. Reumatologia. 2025 Feb;63(1):35-40.
Cheng S, Wu S, Wang N, Xu W, Wei F, Ao W, Yuan L, Ning X, Mao Y, Zhang X, Mao G. Systemic lupus erythematosus complicated by retroperitoneal fibrosis: A case report and literature review. Medicine (Baltimore). 2025 Jan 3;104(1):e41208.
Dai X, Fan Y, Zhao X. Systemic lupus erythematosus: updated insights on the pathogenesis, diagnosis, prevention and therapeutics. Signal Transduct Target Ther. 2025 Mar 17;10(1):102.
Accapezzato D, Caccavale R, Paroli MP, Gioia C, Nguyen BL, Spadea L, Paroli M. Advances in the Pathogenesis and Treatment of Systemic Lupus Erythematosus. Int J Mol Sci. 2023 Mar 31;24(7):6578.
Su X, Yu H, Lei Q, Chen X, Tong Y, Zhang Z, Yang W, Guo Y, Lin L. Systemic lupus erythematosus: pathogenesis and targeted therapy. Mol Biomed. 2024 Oct 30;5(1):54.
Vale ECSD, Garcia LC. Cutaneous lupus erythematosus: a review of etiopathogenic, clinical, diagnostic and therapeutic aspects. An Bras Dermatol. 2023 May-Jun;98(3):355-372.
Lazar S, Kahlenberg JM. Systemic Lupus Erythematosus: New Diagnostic and Therapeutic Approaches. Annu Rev Med. 2023 Jan 27;74:339-352.
Aringer M, Johnson SR. Classifying and diagnosing systemic lupus erythematosus in the 21st century. Rheumatology (Oxford). 2020 Dec 5;59(Suppl5):v4-v11.
Yu H, Nagafuchi Y, Fujio K. Clinical and Immunological Biomarkers for Systemic Lupus Erythematosus. Biomolecules. 2021 Jun 22;11(7):928.
Lv X, Liu W, Zhou X, Yang Y, Zhao W, Meng L, Mu F, Zhang Z, Zhu S, Zhang S, Wang Y. Exosomes in Systemic Autoimmune Diseases: Recent Advances in Diagnostic Biomarkers and Therapeutic Applications. Int J Nanomedicine. 2025 Apr 21;20:5137-5160.
Chen W, Wang X, Huang G, Sheng Q, Zhou E. Identification of cellular senescence-related genes as biomarkers for lupus nephritis based on bioinformatics. Front Genet. 2025 Apr 11;16:1551450.
Athanassiou P, Athanassiou L, Kostoglou-Athanassiou I, Shoenfeld Y. Targeted Cellular Treatment of Systemic Lupus Erythematosus. Cells. 2025 Jan 31;14(3):210.
Elia A, Zucchi D, Silvagni E, Oliva M, Cascarano G, Cardelli C, Ciribè B, Bortoluzzi A, Tani C. Systemic lupus erythematosus: one year in review 2025. Clin Exp Rheumatol. 2025 Mar;43(3):397-406.
Schilirò D, Silvagni E, Ciribè B, Fattorini F, Maccarrone V, Elefante E, Signorini V, Zucchi D, Cardelli C, Bortoluzzi A, Tani C. Systemic lupus erythematosus: one year in review 2024. Clin Exp Rheumatol. 2024 Mar;42(3):583-592.